
記事ID : 34081
治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか? CYTOSKELETON NEWS 2018年5月号

治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
ユビキチン-プロテアソーム系 (UPS) は細胞内のタンパク質分解システムであり、このシステムの機能障害は神経変性やがんなどの多くの疾患に関与しています1,2。UPS は主に、ユビキチン (Ub) やUb リガーゼ、 Ub 加水分解酵素(脱ユビキチン化酵素 (DUBs))、プロテアソームで構成されています。UPS の活性化は、Ub リガーゼによる3三段階のカスケードによって 8 kDa のユビキチンタンパク質が標的タンパク質へ付加されることから始まります。Ub自身がユビキチン化することで、プロテアソームの認識マーカーおよび分解マーカーとなるポリユビキチン化が生じます(図1)。ただし、モノユビキチン化のようにタンパク質の機能を制御する Ub特異的連鎖は複数存在するため、これは非常に単純化したものと言えます1-3。疾患における UPS機能障害が蔓延し、ユビキチン化によるタンパク質分解機構の分子レベルでの解明が進んでいるため、治療介入を目的として USP を標的とすることへの関心は高まっています。
ポリユビキチン化タンパク質の制御された分解におけるプロテアソームの役割および がんにおけるプロテアソームの機能不全から、研究者達はプロテアソームの阻害が がん性悪液質(消耗症候群)治療に効果があるのではないかという仮説を立てました4。そしてこの仮説により、MG-1325 の初期プロテアソーム阻害剤の開発に拍車が掛かりました。MG-132 の薬理学的性質は臨床利用への妨げにはなったものの、後に FDA に承認を受けるボルテゾミブ (BTZ) やカルフィルゾミブと言う唯一の UPS ベース薬剤の開発へと導くプロテアソーム阻害剤の創薬のきっかけとなりました。これらの薬剤は、固形腫瘍への効果はほとんど示しませんでしたが、多発性骨髄腫 (MM) 発症患者の疾患進行を著しく遅らせました6,7。
チューブリンによる苦労:BTZによるプロテアソーム標的
微小管 (MT)ネットワークと Ub との関連性は数十年前から観察されていましたが、Ub はチューブリンではなく、微小管関連タンパク質と結合すると考えられていました8。改良型 Ub 検出方法を用いた近年の研究では、チューブリンがユビキチン化されることが確認されており9-11、この修飾が、微小管の動態や機能と同様にα/β-チューブリンの回転率を制御しています。しかしながら、ユビキチン化による微小管動態の制御方法はまだ完全には解明されていません。たとえば、いくつかの研究ではチューブリンの回転メカニズムとしてUb は同定されていますが11,12、一方で Ub が安定のために重要であるとも示唆されています13。さらに、いくつかの研究ではモノおよび連鎖特異的なユビキチン化がチューブリン単量体や α/β ヘテロ二量体、MT を制御する方法を調べた研究はほとんどありません。
ボルテゾミブ 治療を受けた多発性骨髄腫患者に見られる主な副作用の一つに、ボルテゾミブ誘発末梢神経障害 (BiPN) があります。 30%の患者がボルテゾミブ誘発末梢神経障害となり、この障害がBTZ 治療による用量制限副作用であることから、BiPN の制御メカニズムを特定することは非常に重要です。培養初代ニューロンや神経細胞培養組織、BiPN の in vivo 齧歯動物モデルでの BTZ治療が、チューブリン重合の増加の引き金となります14-16。 これらのデータはBiPNにおける微小管動態の未制御が強く関係することを示すが、これらの研究では、BTZがどのように重合を促進するかについては明らかにできませんでした。BTZ は精製チューブリンの重合に影響しなかったため、パクリタキセルと類似した機序にて BTZ が重合促進するという考えは除外されました17。興味深いものとして、チューブリンのユビキチン化の BTZ 制御が重合を変化させると言う仮説があります。近年の研究では、Ub E3 リガーゼである Mahogunin の欠損によりチューブリン重合が減少すること示唆されており、BTZ誘発チューブリン重合がユビキチン化されたαチューブリンの蓄積によるものである可能性を裏付けています13。
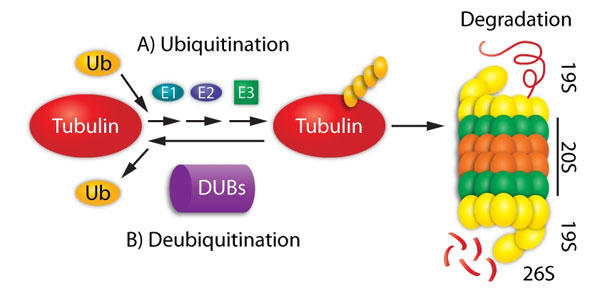
図1. UPS介在型チューブリン分解の模式図
チューブリンのユビキチン化制御:ユビキチンリガーゼおよび脱ユビキチン化酵素の標的
疾患においては、Ub リガーゼおよびDUB が制御されなくなってしまうため、これらの酵素の標的に着目することは、UPS システムの制御にとって更な機会を提供します。Ub ライゲーションは、E1活性化酵素や E2 コンジュゲート酵素、 E3 リガーゼを介して、段階的に引き起こされます(図1)。ヒトでは、 2種類のUb E1 酵素、約38種類の E2 酵素、そして約700種類の E3酵素が存在します。創薬の試みは酵素のグループ毎に行われております。E1 酵素を標的とする場合は全てのユビキチン化阻害をするものの探索ですが、特定の E3リガーゼの場合では、いくつかのタンパク質を特異的に制御するものの探索を目的として行われています2。DUB は 100種類近く存在しており、研究用ツールとして一般的に使用されている DUB阻害剤はありますが、臨床で試験されたことのあるものは一つもありません18。これまで、多くの Ub-制御タンパク質が小分子にとって最適な標的ではないため、 有効な Ub阻害剤の開発は困難を極めています。 それでもなお、Ubリガーゼや DUB に特異的な薬剤の探索はプロテアソーム阻害剤と比べて特異性を向上する可能性があるため、価値があると考えられています。さらに、Ubタグを付加することなくタンパク質の安定化/蓄積へと導き、標的タンパク質の分解を防ぐ際に有用な可能性があります(例:腫瘍抑制タンパク質)19。
α/β-チューブリンのヘテロ二量体は、Parkin(α/β-チューブリン)やユビキチンC末端加水分解酵素 L1 UCHL1(α/β-チューブリン)、Mahogunin(α-チューブリン)を含む様々な Ubリガーゼの標的です11-13(図1)。Parkinは一般的にパーキンソン病 (PD) で遺伝子変異がみられ12、Ub 依存的な機序を介したミトコンドリアの品質管理も制御しているため、特に興味深いリガーゼです20。野生型の Parkin はα およびβ-チューブリンのユビキチン化を制御し、MT と強く関係し、毒性チューブリン単量体のプロテアソームを介した分解を促進します12。反対に、PD患者でみられる Parkin 変異体は、チューブリンをユビキチン化出来ず、分解を促進しません12。同様に、β-チューブリンのポリユビキチン化は、PD患者に存在する内在性神経毒1BnTIQ の類似体とβ-チューブリンの結合により阻害され10、チューブリン単量体の有毒な蓄積をもたらす可能性があります。乳がんおよび卵巣がん感受性タンパク質 (BRCA1) や Cullin 4A, 4B のような Ub リガーゼは、微小管の重合核形成にとって重要な γ-チューブリンのユビキチン化を制御します。21,22。近年では、脱ユビキチン化酵素 BAP1 がγ-チューブリンユビキチン化および MT による有糸分裂異常を制御することが示されています23。
まとめ
BiPN の副作用で見られた非特異性の問題などより、有効なUPS薬剤の開発は困難であるものの、UPS がヒトの健康や疾患において重要な役割を担うため、バイオ医薬品業界は開発を目指し続けています。 本ニュースレターで述べた通り、UPS 内でより多くの特異的な薬剤標的が必要とされており、Ub リガーゼもしくは DUBに存在する可能性があります。 非特異的に効果的な標的となりそうなチューブリンを制御する Ub リガーゼや DUB の同定が初期段階である一方、Parkin やUCH-L1、BTCA1のような現在同定済みのユビキチンリガーゼは細胞プロセスや疾患病状を確実に制御しており、間違いなく治療標的として研究対象となるでしょう。 サイトスケルトン社では、異なるUPS阻害剤の評価や、ユビキチン化タンパク質の内在性レベルの同定や測定に不可欠な研究ツール となるSignal-Seeker™ Ubiquitination Detection Kit を提供しています。
参考文献
- Gong B. et al. 2016. The ubiquitin-proteasome system: Potential therapeutic targets for Alzheimer's disease and spinal cord injury. Front. Mol. Neurosci. 9, 4.
- Huang X. and Dixit V.M. 2016. Drugging the undruggables: exploring the ubiquitin system for drug development.Cell Res. 26, 484-498.
- Swatek K.N and Komander D. 2016. Ubiquitin modifications. Cell Res. 26, 399-422.
- Temparis S. et al. 1994. Increased ATP-ubiquitin-dependent proteolysis in skeletal muscles of tumor-bearing rats. Cancer Res. 54, 5568-5573.
- Goldberg AL. 2012. Development of proteasome inhibitors as research tools and cancer drugs. J. Cell Biol. 199, 583-588.
- Hideshima T. et al. 2001. The proteasome inhibitor PS-341 inhibits growth, induces apoptosis, and overcomes drug resistance in human multiple myeloma cells. Cancer Res. 61, 3071-3076.
- Kortuem K.M. and Stewart A.K. 2013. Carfilzomib. Blood. 121, 893-897.
- Murti K.G. et al. 1988. Ubiquitin is a component of the microtubule network. Proc. Natl. Acad. Sci. USA. 85, 3019-3023.
- Xu G. et al. 2010. Global analysis of lysine ubiquitination by ubiquitin remnant immunoaffinity profiling. Nat. Biotechnol. 28, 868-873.
- Kohta R. et al. 2010. 1-Benzyl-1,2,3,4-tetrahydroisoquinoline binds with tubulin beta, a substrate of parkin, and reduces its polyubiquitination. J. Neurochem. 114, 1291-1301.
- Bheda A. et al. 2010. Ubiquitin editing enzyme UCH L1 and microtubule dynamics: Implication in mitosis. Cell Cycle. 9, 980-994.
- Ren Y. et al. 2003. Parkin binds to alpha/beta tubulin and increases their ubiquitination and degradation. J. Neurosci. 23, 3316-3324.
- Srivastava D. and Chakrabarti O. 2014. Mahogunin-mediated alpha-tubulin ubiquitination via noncanonical K6 linkage regulates microtubule stability and mitotic spindle orientation. Cell Death Dis. 5, e1064.
- Chauhan D. et al. 2011. In vitro and in vivo selective antitumor activity of a novel orally bioavailable proteasome inhibitor MLN9708 against multiple myeloma cells. Clin. Cancer Res. 17, 5311-5321.
- Meregalli C. et al. 2014. Evaluation of tubulin polymerization and chronic inhibition of proteasome as citotoxicity mechanisms in bortezomib-induced peripheral neuropathy. Cell Cycle. 13, 612-621.
- Staff N.P. et al. 2013. Bortezomib alters microtubule polymerization and axonal transport in rat dorsal root ganglion neurons. Neurotoxicology. 39, 124-131.
- Poruchynsky M.S. et al. 2008. Proteasome inhibitors increase tubulin polymerization and stabilization in tissue culture cells: A possible mechanism contributing to peripheral neuropathy and cellular toxicity following proteasome inhibition. Cell Cycle. 7, 940-949.
- Lill J.R. and Wertz I.E. 2014. Toward understanding ubiquitin-modifying enzymes: From pharmacological targeting to proteomics. Trends Pharmacol. Sci. 35, 187-207.
- Chauhan D. et al. 2012. A small molecule inhibitor of ubiquitin-specific protease-7 induces apoptosis in multiple myeloma cells and overcomes bortezomib resistance. Cancer Cell. 22, 345-358.
- Pickrell A.M. and Youle R.J. 2015. The roles of PINK1, parkin, and mitochondrial fidelity in Parkinson's disease. Neuron. 85, 257-273.
- Starita L.M. et al. 2004. BRCA1-dependent ubiquitination of gamma-tubulin regulates centrosome number. Mol. Cell Biol. 24, 8457-8466.
- Thirunavukarasou A. et al. 2015. Cullin 4A and 4B ubiquitin ligases interact with gamma-tubulin and induce its polyubiquitination. Mol. Cell Biochem. 401, 219-28.
- Zarrizi R. et al. 2014. Deubiquitination of gamma-tubulin by BAP1 prevents chromosome instability in breast cancer cells. Cancer Res. 74, 6499-6508.
活性化アッセイキット
[商品詳細]
- Signal-Seeker™ ユビキチン化タンパク質濃縮キット
- 翻訳後修飾の解析に
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Signal-SeekerTM Ubiquitin Detection Kit |
CYT | BK161-S | 10 ASSAY |
¥121,000 |
Signal-SeekerTM Ubiquitin Detection Kit |
CYT | BK161 | 30 ASSAY |
¥239,000 |
Ubiquitin Affinity Beads |
CYT | UBA01 | 40 RXN [4x420 ul] |
販売終了 |
Control for Ubiquitin Affinity Beads |
CYT | CUB02-BEADS | 10 ASSAY |
CYT社 CUB02BBEADS 10 を参照 |
Spirochrome™ 生細胞イメージングプローブ
[商品詳細]
- Spirochrome プローブ(SiR700-Actin / SiR700-Tubulin / SiR700-DNA)
- 細胞骨格(アクチン・チューブリン)やDNAを超解像度で蛍光観察 - Spirochrome プローブ(SiR-Actin/SiR-Tubulin/SiR-DNA)
- 細胞骨格(アクチン・チューブリン)やDNAを超解像度で蛍光観察
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
SiR700-Actin Kit |
CYT | CY-SC013 | 1 KIT [35-200 slides] |
¥180,000 |
SiR700-Tubulin Kit |
CYT | CY-SC014 | 1 KIT [35-200 slides] |
¥180,000 |
SiR700-DNA Kit |
CYT | CY-SC015 | 1 KIT [35-200 slides] |
¥119,000 |
SiR-Actin Kit |
CYT | CY-SC001 | 1 KIT [50-300 slides] |
¥180,000 |
SiR-Tubulin Kit |
CYT | CY-SC002 | 1 KIT [50-300 slides] |
¥180,000 |
SiR-DNA Kit |
CYT | CY-SC007 | 1 KIT [50-300 slides] |
¥119,000 |
Cytoskeleton Kit (SiR-Actin + SiR-Tubulin) |
CYT | CY-SC006 | 1 KIT [50-300 slides] |
販売終了 |
チューブリンアッセイキット
[商品詳細]
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Tubulin Polymerization Assay |
CYT | BK011P | 1 KIT [96 assays] |
¥302,000 |
Tubulin Polymerization Assay Kit, Porcine |
CYT | BK004P | 1 KIT [24 assays] |
¥209,000 |
Tubulin Polymerization Assay Kit |
CYT | BK006P | 1 KIT [24 assays] |
¥298,000 |
Microtubule Binding Protein Spin Down Assay Kit |
CYT | BK029 | 1 KIT [30-100 assays] |
¥251,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













