記事ID : 33618
翻訳後修飾によるがん抑制遺伝子p53の機能の調整 CYTOSKELETON NEWS 2018年2月号

がん抑制遺伝子p53の翻訳後修飾による機能の調整
マルチドメインで四量体であるp53タンパク質は、1979年に発見され1-3、その本当の機能が強力ながん抑制機能だと分かるまでは、がん遺伝子だと考えられていました4, 5。p53は、2つのN末端転写活性調整ドメイン(TAD1, TAD2)、プロリンリッチドメイン(P-rich)、DNA結合ドメイン(DBD)、リンカードメイン、四量体形成ドメイン(TD)、リジンリッチC末端調整ドメイン(REG) から成ります5(図1)。p53は転写因子として、最大3,000個の遺伝子の発現調節をしています。その中にはアポトーシス、老化、細胞周期の停止、DNA修復、細胞死、腫瘍微小環境、オートファジー、がんの浸潤・転移が含まれています6-8。p53の機能は時間空間的に複数のドメインで起きる50種の翻訳後修飾 (PTM) によって制御されています9-12(図 1)。本稿では、ユビキチン化、リン酸化、アセチル化によるp53の制御について述べていきます。
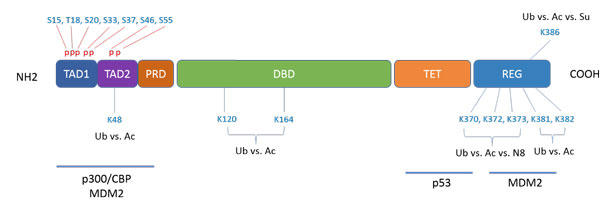
図1. p53の翻訳後修飾
p53は複数ドメインにおいて、おおよそ50個の翻訳後修飾を受ける。これらの翻訳後修飾は互いに依存せず、連携性がないが、お互いに阻害し合うこともある。
ユビキチン化
ストレスがなく正常に細胞が成長している間は、E3ユビキチンリガーゼ (MDM2: mouse double minute 2; ヒト相同体, HDM2)が、ユビキチン−プロテアソームを制御して、MDM2、p53、p300/CREB結合タンパク質からなるタンパク質複合体(p300/CBP)を分解することにより、p53の発現を最低限に抑えています13, 14。MDM2は、p53のTAD1と結合し、それでp53のREGドメイン中の6個のリジン(図 1)のポリユビキチン化を媒介し、p53を負の方向に抑制しています15。重要なことは、MDM2はp53の複数の個所でモノユビキチン化を直接媒介しているということです16。しかし、ポリユビキチン化については直接的に関与していません。その代わり、p300/CBPはユビキチンリガーゼとアセチルトランスフェラーゼ活性の両方を持っており、モノユビキチン化リジン残基をポリユビキチン化の基質として使います13, 14。注目すべきはおびただしい他のE3リガーゼ、たとえばPirh2, COP1, CHIP, ARF-BP1, E6-AP, TOPORS, TRIM24, MKRN1などがp53を制御しています9。
リン酸化
セリン/スレオニン (Ser/Thr) 残基のリン酸化は、p53を安定化し、活性化するもので、遺伝毒性によるダメージ、発がん遺伝子の活性化、過剰増殖シグナル、低酸素症、栄養不良などの細胞内ストレスによって引き起こされるものです17, 18。活性化されると、四量体p53は、目標となる遺伝子のプロモーターのところで活性型転写複合体を形作り、遺伝子の発現を制御し、細胞周期を停止させたり、細胞死に導いたりします。おそらく、p53の活性を司っている一番重要なリン酸エピトープはSer15です。Ser15のリン酸化は、続いて起こる他のp53の残基(Thr18やSer20)のリン酸化に必要だからです9, 19。実際、Thr18のリン酸化はMDM2が結合するのを阻害するのに必要な触媒です。TAD1においてまとまって存在しているセリン残基 (Ser20、Ser33、Ser37、Ser46、Ser55)のリン酸化によって、MDM2のp53への結合力がさらに低下します9, 19-26(図1)。MDM2の結合力が低下するのに伴い、共転写活性化因子のp300/CBPが代わりにp53に結合します9, 19。この結合は、Ser15とThr18のリン酸化に依存しています21, 22。p300/CBPは構造的に類似した4個のドメイン(TAZ1、 KIX、TAZ2、NCBD)を持っており、p53のTADにそれぞれ違う強さで結合します24-26。p53の二箇所のリン酸化により、MDM2はp53から離れ、近傍のセリン残基のリン酸化が連続して起きることで(Thr18と比較して最大80倍)、KIXとTAZ1の両ドメインに対するp53の結合力が緩やかに上昇します9, 24-26。p300/CBPはp53に結合して、p53の複数個所のリン酸化を緩やかに増加させます。22, 24, 26
アセチル化
リン酸化に加えて、p300/CBPが媒介するアセチル化が、細胞内ストレスに応答したときのp53の安定化と活性化に不可欠です27-29。p53のREGドメインにおける6個のリジン残基(Lys370、Kys372、Lys373、Lys381、Lys382、Lys386) は、p300/CBPによるアセチル化の標的となります。このアセチル化により、MDM2が媒介するこれらのリジン残基のユビキチン化が阻害され、p53のトランス活性化能を保ちます9, 28。しかも、p53のアセチル化は、リン酸化の状態に関係なく、p53とMDM2の相互作用を不安定化させるのに不可欠なものです。p53のDBDの2つのリジン(Lys120、Lys164)とREGドメインの6個のリジンのアセチル化は、MDM2がp53複合体結合プロモーターに結合するのを阻害し、p53が媒介するストレス応答を可能にします29(図1)。MDM2はHDAC1複合体を通じてp53の脱アセチル化を促進します28。これによりp53がポリユビキチン化され、最終的にプロテアソームにより分解されます。
まとめ
四量体p53がん抑制タンパク質は、細胞周期の停止、細胞死、それに関する経路について何千もの遺伝子の発現を制御しています。それゆえ、MDM2とp300/CBPが媒介するポリユビキチン化により強固に負の制御を受けています。細胞ストレスによりp53はリン酸化・アセチル化されることで、安定化・活性化されます。HDAC1が媒介する脱アセチル化によって、次の細胞ストレスを受けるまでp53は静止状態になっています。p53や他のがん関連タンパク質が翻訳後修飾によってどのように制御されているのかを理解するために、Cytoskeleton社では、Signal-Seeker Enrichment Kitsをご用意しております。この商品で、細胞や組織ライセートにおけるチロシンリン酸化、ユビキチン化、アセチル化、SUMO化の細胞内濃度を研究することができます。また、多くの実験に利用できるPTM抗体もご用意しております。
参考文献
- Kress M. et al. 1979. Simian virus 40-transformed cells express new species of proteins precipitable by anti-simian virus 40 tumor serum. J. Virol. 31, 472-483.
- Lane D.P. and Crawford L.V. 1979. T antigen is bound to a host protein in SV40-transformed cells. Nature. 278, 261-263.
- Linzer D.I. and Levine A.J. 1979. Characterization of a 54K dalton cellular SV40 tumor antigen present in SV40-transformed cells and uninfected embryonal carcinoma cells. Cell. 17, 43-52.
- Soussi T. 2010. The history of p53. A perfect example of the drawbacks of scientific paradigms. EMBO Rep. 11, 822-826.
- Vousden K.H. and Prives C. 2009. Blinded by the light: the growing complexity of p53. Cell. 137, 413-431.
- Bieging K.T. et al. 2014. Unravelling mechanisms of p53-mediated tumour suppression. Nat. Rev. Cancer. 14, 359-370.
- Fischer M. et al. 2017. Census and evaluation of p53 target genes. Oncogene. 36, 3943?3956.
- Kruiswijk F. et al. 2015. p53 in survival, death and metabolic health: a lifeguard with a licence to kill. Nat. Rev. Mol. Cell Biol. 16, 393-405.
- Meek D.W. and Anderson C.W. 2009. Posttranslational modification of p53: cooperative integrators of function. Cold Spring Harb. Perspect. Biol. 1, a000950.
- Kruse J.P. and Gu W. 2009. Modes of p53 regulation. Cell. 137, 609-622.
- Carter S. and Vousden K.H. 2009. Modifications of p53: competing for the lysines. Curr. Opin. Genet. Dev. 19, 18-24.
- Bode A.M. and Dong Z. 2004. Post-translational modification of p53 in tumorigenesis. Nat. Rev. Cancer. 4, 793-805.
- Grossman S.R. et al. 1998. p300/MDM2 complexes participate in MDM2-mediated p53 degradation. Mol. Cell. 2, 405-415.
- Grossman S.R. et al. 2003. Polyubiquitination of p53 by a ubiquitin ligase activity of p300. Science. 300, 342-344.
- Rodriguez M.S. et al. 2000. Multiple C-terminal lysine residues target p53 for ubiquitin-proteasome-mediated degradation. Mol. Cell Biol. 20, 8458-8467.
- Lai Z. et al. 2001. Human mdm2 mediates multiple mono-ubiquitination of p53 by a mechanism requiring enzyme isomerization. J. Biol. Chem. 276, 31357-31367.
- Giaccia A.J. and Kastan M.B. 1998. The complexity of p53 modulation: emerging patterns from divergent signals. Genes Dev. 12, 2973-2983.
- Hu W. et al. 2012. The regulation of multiple p53 stress responses is mediated through MDM2. Genes Cancer. 3, 199-208.
- Saito S. et al. 2003. Phophorylation site interdependence of human p53 post-translational modifications in response to stress. J. Biol. Chem. 278, 37536-37544.
- Shieh S.-Y. et al. 1997. DNA damage-induced phosphorylation of p53 alleviates inhibition by MDM2. Cell. 91, 325-334.
- Lambert P.F. et al. 1998. Phosphorylation of p53 serine 15 increases interaction with CBP. J. Biol. Chem. 273, 33048-33053.
- Lee C.W. et al. 2010. Graded enhancement of p53 binding to CREB-binding protein (CBP) by multi-site phosphorylation. Proc. Natl. Acad. Sci. U.S.A. 107, 19290-19295.
- Dumaz N. and Meek D.W. 1999. Serine 15 phosphorylation stimulates p53 transactivation but does not directly influence interaction with HDM2.EMBO J. 18, 7002-7010.
- Teufel D.P. et al. 2007. Four domains of p300 each bind tightly to a sequence spanning both transactivation subdomains of p53. Proc. Natl. Acad. Sci. U.S.A. 104, 7009-7014.
- Ferreon J.C. et al. 2009. Cooperative regulation of p53 by modulation of ternary complex formation with CBP/p300 and HDM2. Proc. Natl. Acad. Sci. U.S.A. 106, 6591-6596.
- Teufel D.P. et al. 2009. Regulation by phosphorylation of the relative affinities of the N-terminal transactivation domains of p53 for p300 domains and Mdm2. Oncogene. 28, 2112-2118.
- Gu W. and Roeder R.G. 1997. Activation of p53 sequence-specific DNA binding by acetylation of the p53 C-terminal domain. Cell. 90, 595-606.
- Ito A. et al. 2002. MDM2-HDAC1-mediated deacetylation of p53 is required for its degradation. EMBO J. 21, 6236-6245.
- Tang Y. et al. 2008. Acetylation is indispensable for p53 activation. Cell. 133, 612-626.
PTM抗体、ビーズ、その他
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti Acetyl Lysine (Mouse)  |
CYT | AAC02 | 2*100 UL |
¥125,000 |
Anti Acetyl Lysine (Trial size) (Mouse)  |
CYT | AAC02-S | 1*25 UL |
¥34,000 |
Anti Acetyl Lysine (Mouse)  |
CYT | AAC03 | 2*100 UL |
¥125,000 |
Anti Acetyl Lysine (Trial size) (Mouse)  |
CYT | AAC03-S | 1*25 UL |
¥34,000 |
Anti Acetyl Lysine (Mouse) Horseradish Peroxidase |
CYT | AAC03-HRP | 1*100 UL |
¥141,000 |
Anti Acetyl Lysine (Trial size) (Mouse) Horseradish Peroxidase |
CYT | AAC03-HRP-S | 1*25 UL |
¥48,000 |
Anti Acetyl Lysine Affinity Beads (Mouse)  |
CYT | AAC04-BEADS | 4*500 UL |
¥197,000 |
Anti Phosphotyrosine Affinity Beads, (Mouse) , 27B10.4 |
CYT | APY03-BEADS | 4*300 UL |
CYT社 APY03BEADS 4*330 を参照 |
Anti Phosphotyrosine, (Mouse) Horseradish Peroxidase, 27B10.4 |
CYT | APY03-HRP | 1*100 UL |
¥141,000 |
Anti SUMO-2/3 Affinity Beads, (Mouse) , 11G2 |
CYT | ASM24-BEADS | 800 UL [2 x 400 μl] |
¥197,000 |
Anti Ubiquitin (Trial size), (Mouse) , P4D2 |
CYT | AUB01-S | 1*25 UL |
¥34,000 |
Anti Ubiquitin, (Mouse) , P4D2 |
CYT | AUB01 | 2*100 UL |
¥125,000 |
Anti Ubiquitin, (Mouse) , P4D1 |
CYT | AUB01-XL | 4*500 UL |
¥268,000 |
Control for Ippt IgG beads |
CYT | CIG01-BEADS | 10 ASSAY |
¥34,000 |
Control for Acetyl- immunoprecipitation IgG beads |
CYT | CIG02-BEADS | 10 ASSAY |
¥34,000 |
Control for Ubiquitin Affinity Beads |
CYT | CUB02-BEADS | 10 ASSAY |
CYT社 CUB02BBEADS 10 を参照 |
Signal-Seeker™ Enrichment Kits
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Signal-SeekerTM Acetyl-Lysine Detection Kit |
CYT | BK163 | 30 ASSAY |
¥239,000 |
Signal-SeekerTM Acetyl-Lysine Detection Kit |
CYT | BK163-S | 10 ASSAY |
¥121,000 |
Signal-SeekerTM Phosphotyrosine Detection Kit |
CYT | BK160 | 30 ASSAY |
¥239,000 |
Signal-SeekerTM Phosphotyrosine Detection Kit |
CYT | BK160-S | 10 ASSAY |
¥121,000 |
Signal-SeekerTM Ubiquitin Detection Kit |
CYT | BK161 | 30 ASSAY |
¥239,000 |
Signal-SeekerTM Ubiquitin Detection Kit |
CYT | BK161-S | 10 ASSAY |
¥121,000 |
Signal-SeekerTM SUMOylation Detection Kit |
CYT | BK162 | 30 ASSAY |
¥239,000 |
Signal-SeekerTM SUMOylation Detection Kit |
CYT | BK162-S | 10 ASSAY |
¥121,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













