記事ID : 35050
軸索再生と細胞骨格 CYTOSKELETON NEWS 2018年11月号

軸索再生と細胞骨格
中枢神経系(CNS)における成体ニューロンの細胞骨格は、微小管(MTs)やF-アクチンを始めとする様々な構造タンパク質で構成されています。正常な細胞機能(形態、運動性、発生、輸送など)はMTsやF-アクチンのダイナミクスに依存しています。さらに、細胞骨格の機能不全は数々のCNS疾患や障害の根底にあります。例えば、軸索障害に続いて生ずる成人の中枢神経系における細胞骨格のダイナミクスは、成長円錐形成、軸索再生、および機能回復には貢献しません。成人の中枢神経系の障害回復におけるMTやF-アクチン細胞骨格の役割を理解し、軸索再生のためにこれらをどのように調節するか検討するためには、軸索障害後の細胞骨格のダイナミクスを理解する必要があります1, 2 。本ニュースレターでは、成人の中枢神経系の軸索再生におけるMTやF-アクチン細胞骨格の役割について協議します。
成人中枢神経系のニューロンでは、生理学的条件下において軸索再生は生じないといった定説があります。これに対し、末梢神経系(PNS)の損傷された軸索は障害を受けて再生されます。この違いを理解するため、1) 内因性再生関連遺伝子(RAGs)の活性化、2) 軸索再成長を阻害する外部の合図、といった成人中枢神経系における2つの顕著な再生関連シグナル伝達カスケードに焦点が当てられています1, 2 。
軸索を再生するには、成体ニューロンが損傷された軸索の尖端に新しい成長円錐を形成して再成長を惹起するする必要があります。この可塑性には、MTやF-アクチン細胞骨格が動的に再編成する必要があります(図1)。
PNSにおける軸索の再生は、MTsやF-アクチンが傷害に応答して軸索再生に関与する細胞内外のシグナル伝達に寄与する上で有用な手引きとなります1, 2 。特に、PNSにおける軸索切断に対して複数の細胞応答がありますが、これはニューロンが成人期に到達するとCNSでは生じない、または著しく減少します。軸索損傷はカルシウム流入を惹起し、HDAC5介在性の軸索MTsの脱アセチル化や軸索再生に必要な翻訳後修飾9-11 を始めとするカルシウム介在性シグナル伝達経路のカスケードを活性化します3-8 。その他のMTsに依存する細胞内傷害誘導性変化として、核局在化やおそらくRAGsの活性化に向けて傷害部位またはその近辺で局所的に翻訳されたタンパク質(様々なキナーゼや転写因子など)を細胞体へ逆行性輸送するものがあります1-2 。タンパク質合成や小胞、オルガネラ(ミトコンドリアなど)、およびRAGs(細胞骨格タンパク質、シナプス性タンパク質など)のMT介在性順行性輸送も生じます1-2, 10, 12-14 。
上述の損傷誘導性変化は成長円錐形成や傷害を受けた軸索の再生に必要です(図1)。PNSの損傷軸索は新しい成長円錐を発生しますが、安定MTsは中心(C-)ドメイン内に存在し、動的MTsは円錐尖端の末梢(P-)ドメインに存在します1, 2, 15 。PNSにおける再生プロセスとは逆に、損傷CNS軸索の遠位尖端は退縮球とよばれる異栄養性構造でキャップされており、軸索再生が妨害されます。退縮球は、脱重合型MTs、解体型MTs、アクチンやチューブリン重合体の分離のないドメイン、および安定化および動的高分子の系統的ではない分布から構成されています1, 2, 15(図1)。成長円柱の器質性ネットワークが不安定化されると、退縮球様構造へと変換されます。これらの知見より、機能障害性のMTのダイナミクスによって成体CNSニューロンが生理的状態において損傷軸索の再生を行えなくなることに寄与することが示唆されます1, 2, 15, 16。予想されたように、退縮球においてMTsが安定化されると成体CNS軸索尖端においてMT重合化が増大し、同時に退縮球形成の減少と成長円錐発生の惹起が生じます1, 2, 16-19。調節不全のMTダイナミクスは、星状細胞や線維芽細胞の成長阻害シグナル伝達カスケードのかみ合いにも関与し、損傷した軸索においてこれら線維性の瘢痕形成細胞が活性化されます1, 16。MTsのタキソールによる安定化を受けて、線維芽細胞からの細胞外マトリックスタンパク質の放出と星状細胞からの成長阻害タンパク質の放出が阻止されます1, 16, 17。したがって、MTsは再生促進機能と抗再生機能に関与すると考えられます。
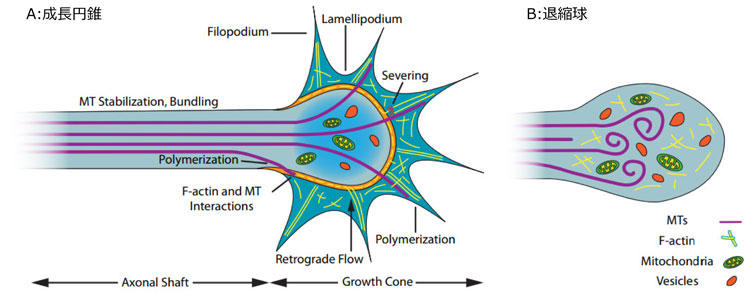
図.1 ニューロンの成長円錐と退縮球におけるMTとF-アクチン細胞骨格系の組織化。
再生している軸索(左パネル)では、安定MTsは軸内(C-ドメイン)に存在し、成長円錐には動的MTsやF-アクチンが存在します(P-ドメイン)。MTsとF-アクチンが動的な状態では、軸索伸展に必要な葉状仮足や糸状仮足の形成や伸展/撤退が可能となります。損傷軸索の尖端において退縮球(右パネル)が形成されると、軸索再生が妨害される。球体内で分離されたドメインが失われ、MTsは脱重合するか解体する。
アクチンも軸索傷害へ応答する成人の中枢神経系において役割を担いますが、MTsに比べるとあまり明らかになっていません。アクチン結合タンパク質である非筋細胞ミオシンIIを阻害するとアクチン細胞骨格が著しく再編成され、予想通りF-アクチンレベルが低減し、糸状仮足形成が増大し、MTのP-ドメインへの突出が促進します。これらや他の効果は最終的に軸索再生を生じます1, 20 。アクチンが軸索再生に影響を及ぼす経路の少なくともひとつはRhoA GTPaseが関与し、細胞外阻害シグナルをアクチン細胞骨格の再編成に関連づけていると考えられています1, 21, 23 。
まとめ
成人の中枢神経系における損傷軸索の再成長に関する謎解きを行う上で、軸索再生においてMTやF-アクチン細胞骨格がどのように動的に制御されているのか完全に理解することが必要です。現在の研究によると、成人の中枢神経系の軸索再生におけるMTsやF-アクチン細胞骨格の役割は少なくとも3段階あります。
- 損傷ニューロンの内因性再生能力を促進
- 損傷関連分子やオルガネラの順行性と逆行性輸送の通路を提供
- 線維症に関与する分子の放出を制御1
MTやF-アクチン細胞骨格を選択的に活性化したり阻害したりできれば、成体CNSニューロンにおける損傷軸索治療研究に大きく貢献できると考えられます。研究者の方々がこれらを遂行できるようCytoskeleton, Inc.では精製アクチン、チューブリンおよび小分子GTPases、これらタンパク質の機能アッセイキット、およびMTsやF-アクチンの生細胞画像試薬といった様々な研究ツールを提供します。
参考文献
- Blanquie O. and Bradke F. 2018. Cytoskeleton dynamics in axon regeneration. Curr. Opin. Neurobiol. 51, 60-69.
- Mar F.M. et al. 2014. Cell intrinsic control of axon regeneration. EMBO Rep. 15, 254-263.
- Ghosh-Roy A. et al. 2010. Calcium and cyclic AMP promote axonal regeneration in Caenorhabditis elegans and require DLK-1 kinase. J. Neurosci. 30, 3175-3183.
- Udina E. et al. 2008. Electrical stimulation of intact peripheral sensory axons in rats promotes outgrowth of their central projections. Exp. Neurol. 210, 238-247.
- Enes J. et al. 2010. Electrical activity suppresses axon growth through Ca(v)1.2 channels in adult primary sensory neurons. Curr. Biol. 20, 1154-1164.
- Chierzi S. et al. 2005. The ability of axons to regenerate their growth cones depends on axonal type and age, and is regulated by calcium, cAMP and ERK. Eur. J. Neurosci. 21, 2051-2062.
- Trakhtenberg E.F. and Goldberg J.L. 2012. Epigenetic regulation of axon and dendrite growth. Front. Mol. Neurosci. 5, 24.
- Lindner R. et al. 2013. Epigenetic regulation of axon outgrowth and regeneration in CNS injury: the first steps forward. Neurotherapeutics. 10, 771-781.
- Cho Y. and Cavalli V. 2012. HDAC5 is a novel injury-regulated tubulin deacetylase controlling axon regeneration. EMBO J. 31, 3063-3078.
- Cho Y. et al. 2013. Injury-induced HDAC5 nuclear export is essential for axon regeneration. Cell. 155, 894-908.
- Gaub P. et al. 2011. The histone acetyltransferase p300 promotes intrinsic axonal regeneration. Brain. 134, 2134-2148.
- Fernandes K.J. et al. 1999. Influence of the axotomy to cell body distance in rat rubrospinal and spinal motoneurons: differential regulation of GAP-43, tubulins, and neurofilament-M. J. Comp. Neurol. 414, 495-510.
- Mandolesi G. et al. 2004. Acute physiological response of mammalian central neurons to axotomy: ionic regulation and electrical activity. FASEB J. 18, 1934-1936.
- Zundorf G. and Reiser G. 2011. Calcium dysregulation and homeostasis of neural calcium in the molecular mechanisms of neurodegenerative diseases provide multiple targets for neuroprotection. Antioxid. Redox. Signal. 14, 1275-1288.
- Erturk A. et al. 2007. Disorganized microtubules underlie the formation of retraction bulbs and the failure of axonal regeneration. J. Neurosci. 27, 9169-9180.
- Hellal F. et al. 2011. Microtubule stabilization reduces scarring and causes axon regeneration after spinal cord injury. Science. 331, 928-931.
- Sengottuvel V. et al. 2017. Taxol facilitates axon regeneration in the mature CNS. J. Neurosci. 31, 2688-2699.
- Ruschel J. et al. 2015. Systemic administration of epothilone b promotes axon regeneration and functional recovery after spinal cord injury. Science. 348, 347-352.
- Witte H. et al. 2008. Microtubule stabilization specifies initial neuronal polarization. J. Cell Biol. 180, 619-632.
- Hur E.M. et al. 2011. Engineering neuronal growth cones to promote axon regeneration over inhibitory molecules. Proc. Natl. Acad. Sci. USA. 108, 5057-5062.
- Lehmann M. et al. 1999. Inactivation of Rho signaling pathway promotes CNS axon regeneration. J. Neurosci. 19, 7537-7547.
- Dergham P. et al. 2002. Rho signaling pathway targeted to promote spinal cord repair. J. Neurosci. 22, 6570-6577.
- Fehlings M.G. et al. 2011. A phase I/IIa clinical trial of a recombinant Rho protein antagonist in acute spinal cord injury. J. Neurotrauma. 28, 787-796.
Tubulin and Actin Live Cell Reagents
[商品詳細]
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
SiR700-Actin Kit |
CYT | CY-SC013 | 1 KIT [35-200 slides] |
¥180,000 |
SiR-Actin Kit |
CYT | CY-SC001 | 1 KIT [50-300 slides] |
¥180,000 |
SiR700-Tubulin Kit |
CYT | CY-SC014 | 1 KIT [35-200 slides] |
¥180,000 |
SiR-Tubulin Kit |
CYT | CY-SC002 | 1 KIT [50-300 slides] |
¥180,000 |
Cytoskeleton Kit (SiR-Actin + SiR-Tubulin) |
CYT | CY-SC006 | 1 KIT [50-300 slides] |
販売終了 |
G-LISA Activation Assay Kits
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
RhoA G-LISA(R) Activation Assay (absorbance) |
CYT | BK124 | 96 ASSAY |
¥302,000 |
RhoA G-LISA(R) Activation Assay (luminescence) |
CYT | BK121 | 96 ASSAY |
¥302,000 |
Tubulin Kits
[商品詳細]
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Tubulin Polymerization Assay Kit |
CYT | BK006P | 1 KIT [24 assays] |
¥298,000 |
Tubulin Polymerization Assay |
CYT | BK011P | 1 KIT [96 assays] |
¥302,000 |
Microtubule Binding Protein Spin Down Assay Kit |
CYT | BK029 | 1 KIT [30-100 assays] |
¥251,000 |
Actin Biochem Kits
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Actin Binding Protein Spin-down Biochem Kit (for muscle) |
CYT | BK001 | 1 KIT [30-100 assays] |
¥254,000 |
Actin Binding Protein Spin-Down Biochem Kit (Non-muscle) |
CYT | BK013 | 1 KIT [30-100 assays] |
¥257,000 |
Actin Polymerization Biochem Kit, Rabbit |
CYT | BK003 | 1 KIT [30-100 assays] |
¥288,000 |
G-Actin : F-Actin In Vivo Assay Kit, Mouse |
CYT | BK037 | 1 KIT [30-100 assays] |
¥250,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













