
記事ID : 36466
表現型プロファイリング:アクチンに焦点を当てたがん治療 CYTOSKELETON NEWS 2019年12月号

表現型プロファイリング:アクチンに焦点を当てたがん治療
アクチンは哺乳動物の細胞骨格に必須の構成成分であり、細胞増殖、運動性、輸送、および、分裂といった多数の生理学的機能に関与しています。これらの基本的な機能には、アクチンを基盤とする神経突起(例えば、lamellipodia;葉状仮足、Filopodia;糸状仮足)の伸展や退縮と同様にアクチン細胞骨格のリモデリングが必要です。これらは線維状アクチン(F-アクチン)と単量体アクチン(G-アクチン)間の迅速な動的サイクルに依存しています1)。このことに相応して、アクチン細胞骨格ダイナミクスの機能障害は多くのヒト疾患の病態生理学的特徴であり、がんが典型的な例です。このような理由から、アクチンは理論的に考えて魅力的な抗がん治療標的です。しかしながら、実際にはアクチンはその有毒な副作用のため標的としてあまり適切でないことが示されています。その理由として、治療においてアクチンのアイソフォームを区別できないことが挙げられます2, 3)。このため、がん細胞および正常細胞内のアクチンは、アクチンに直接作用するがん治療の影響を受けて様々な臓器系(例えば、心臓や横隔膜)に毒性副作用を引き起こします2, 3)。近年、創薬はアクチンからArp2/3複合体やトロポミオシン(Tpms)のようなアクチン関連構造タンパク質へと移行しています。これらのタンパク質には選択標的を可能にする複数のアイソフォームがあり、毒性副作用を避けられる可能性があるためです2-4)(Fig. A)。
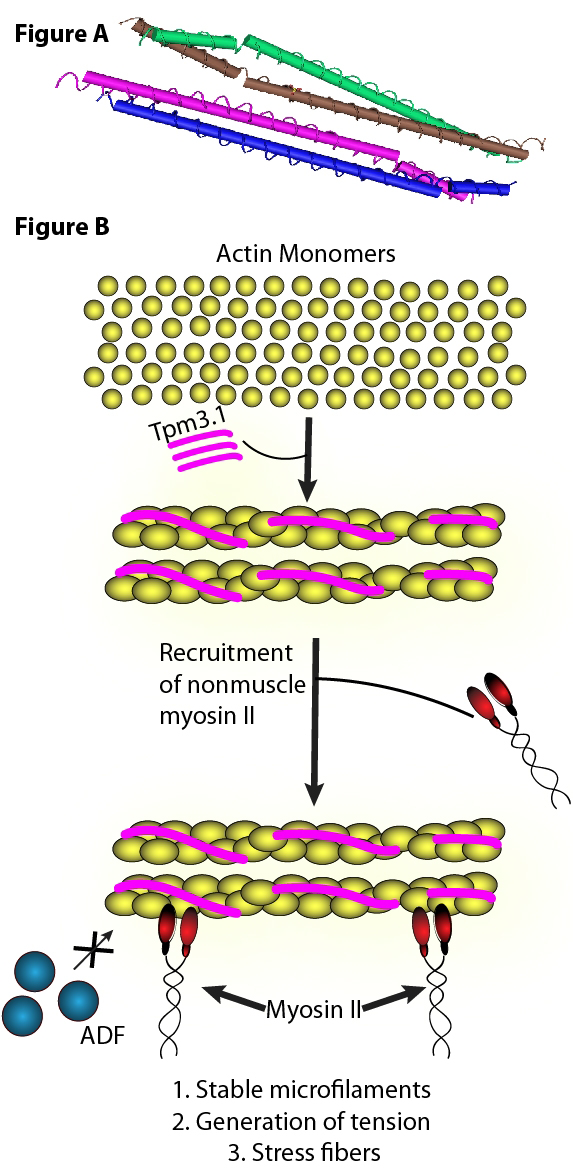
Fig. A:トロポミオシンアイソフォーム3.1(Tpm3.1)は、がん関連アクチン結合タンパク質です。Tpm3.1のN末端断片の結晶構造。PDB ID: 60TN。
Fig. B:Tpm3.1はF-アクチンが非筋肉ミオシンIIおよびADF/コフィリンとどのように相互作用するかを制御する。参考文献[12]より引用。
構造タンパク質を標的としたアクチンダイナミクスを制御する薬物の開発には多くの課題があります。合理的な薬物設計を始める前に、機能ドメインマッピングと潜在的な薬物結合ポケットを同定し標的タンパク質の構造知識を取得します3)。Arp2/3やTpmsのようなアクチン関連制御タンパク質ではこれらのデータがありません(Fig. A)。完全な構造データがない場合、研究者は標的タンパク質に対する既存の化合物ライブラリを用いて機能阻害する薬物をスクリーニングします3)。推定される治療標的の特性は、特に特定のアイソフォームのみが疾患に関連している場合、選択的ターゲティングの可能性を提供する複数のアイソフォームの存在です。さらに、構造的なアイソフォームはより多くの薬物結合ポケットを提供します。これは、別の薬物が潜在的に異なる作用機序を介して同じタンパク質を調節できることを意味します。既存の低分子化合物ライブラリを利用し、アクチン結合タンパク質候補の構造知識の欠如に対処するために採用されている1つの技術は、表現型プロファイリングです3)。このスクリーニングプロトコルは、細胞イメージングを利用し、細胞サイズ、形態を含む複数の複雑な細胞構造に化合物がどのように影響するかを測定します。アクチンの場合には、関連する生物学的作用を有する化合物を同定するため、計算および自動画像分析によってフィラメントの詳細な特徴(数、長さ、形状、細胞内分布、シグナル強度)を測定します。さらに、関連する化合物の作用機序が既知の場合、得られた情報はこの化合物をさらに評価し、類似の表現型を有する他の化合物の作用機序を予測するためにも使用されます3, 7)。
Arp2/3複合体およびTpmsは、がん創薬プログラムにおける有望な治療標的です3, 8-12)。Arp2/3の活性は、異なる作用機序を介して異なる薬物によって阻害されます11)。Tpmアイソフォームは、アクチン調節薬に対するF-アクチンの感受性を特異的に制御します3, 12)。Tpmsは40以上のアイソフォームがあり、細胞/組織の発生段階において、個々に空間的・時間的局在パターンを示します12)。アクチン細胞骨格は、アクチンとTpmの共重合体とTpmなしのアクチンの重合体の両方から構成されていますが13)、最近の研究ではTpmsがヒト細胞のFアクチンの大部分を覆っていることが報告されています14)。Tpmsは、アイソフォーム依存的にアクチンフィラメントの機能的能力を決定します15-21)(Fig. A)。治療標的としてさらなる研究に適しているタンパク質の重要な特徴のひとつに、がん細胞での活性/発現の特異的な調節があります。Tpmsでは、アイソフォーム3.1は複数のがん細胞株において有意かつ選択的に上方制御されています。それゆえ、特異的に標的化が可能な疾患関連アイソフォームといえます2, 14, 22, 23)(Fig. A)。また、筋肉のTpmsがこのアイソフォームを発現しないため、Tpm3.1を標的とすることで毒性副作用を回避できる点が重要です22, 24, 25)。現在研究されているのは、Tpm3.1の結合ポケット内の異なる分子相互作用を介してTpm3.1を選択的に標的とする構造的に特異的な3つの低分子化合物です3, 22, 24, 25)。
まとめ
新規抗がん治療標的としてアクチン関連構造タンパク質を研究することは、特異的な新しいがん治療法の開発に大きな可能性をもたらしますが、表現型スクリーニングを用いる場合にはいくつかの注意点と方法論的考察があります。例えば、
- 候補細胞株は、高度に保存されたアクチン細胞骨格を有していなければならない。
- アクチン細胞骨格染色は自動化操作に対応しなければならない。
- 異なるアクチン表現型は、特定のスクリーニングセットアップを用いて検出可能でなければならず、複数のパラメータが測定可能でなければならない(例えば、フィラメント数と長さ、細胞の形態と大きさ、F-アクチンの細胞内分布とその異なる構造形態など)。
- 心筋細胞と骨格筋細胞内のアクチンダイナミクスに影響を与えてはならない。3)
参考文献
- Pollard T.D. 2016. What we know and do not know about actin. In: Jockusch B. (eds.) The Actin Cytoskeleton. Handbook of Experimental Pharmacology. vol. 235. Springer, Cham.
- Bonello T.T. et al. 2009. New approaches to targeting the actin cytoskeleton for chemotherapy. Future Med. Chem. 1, 1311-1331.
- Bryce N.S. et al. 2019. Chemical biology approaches targeting the actin cytoskeleton through phenotypic screening. Curr. Opin. Chem. Biol. 51, 40-47.
- Creed S.J. et al. 2008. Tropomyosin isoforms define distinct microfilament populations with different drug susceptibility. Eur. J. Cell Biol. 87, 709-720.
- Feng Y. et al. 2009. Multi-parameter phenotypic profiling: using cellular effects to characterize small-molecule compounds. Nat. Rev. Drug Discov. 8, 567-578.
- Eliceiri K.W. et al. 2012. Biological imaging software tools. Nat. Methods. 9, 697-710.
- Caicedo J.C. et al. 2017. Data-analysis strategies for image-based cell profiling. Nat. Methods. 14, 849-863.
- Jay P. et al. 2000. ARP3beta, the gene encoding a new human actin-related protein, is alternatively spliced and predominantly expressed in brain neuronal cells. Eur. J. Biochem. 267, 2921-2928.
- Millard T.H. et al. 2003. Identification and characterisation of a novel human isoform of Arp2/3 complex subunit p16-ARC/ARPC5. Cell Motil. Cytoskeleton. 54, 81-90.
- Abella J.V. et al. 2016. Isoform diversity in the Arp2/3 complex determines actin filament dynamics. Nat. Cell Biol. 18, 76-86.
- Nolen B.J. et al. 2009. Characterization of two classes of small molecule inhibitors of Arp2/3 complex. Nature. 460, 1031-1034.
- Gunning P.W. et al. 2015. Tropomyosin - master regulator of actin filament function in the cytoskeleton. J. Cell Sci. 128, 2965-2974.
- Lazarides E. 1976. Two general classes of cytoplasmic actin filaments in tissue culture cells: the role of tropomyosin. J. Supramol. Struct. 5, 531-563.
- Meiring J.C.M. et al 2018. Co-polymers of actin and tropomyosin account for a major fraction of the human actin cytoskeleton. Curr. Biol. 28, 2331-2337.
- Bryce N.S. et al. 2003. Specification of actin filament function and molecular composition by tropomyosin isoforms. Mol. Biol. Cell 14, 1002-1016.
- Tojkander S. et al. 2011. A molecular pathway for myosin II recruitment to stress fibers. Curr. Biol.21, 539-550.
- Creed S.J. et al. 2011. Tropomyosin isoform 3 promotes the formation of filopodia by regulating the recruitment of actin-binding proteins to actin filaments. Exp. Cell Res. 317, 249-261.
- Janco M. et al. 2016. The impact of tropomyosins on actin filament assembly is isoform specific. Bioarchitecture 6, 61-75.
- Brayford S. et al. 2016. Tropomyosin promotes lamellipodial persistence by collaborating with Arp2/3 at the leading edge. Curr. Biol. 26, 1312-1318.
- Gateva G. et al. 2017. Tropomyosin isoforms specify functionally distinct actin filament populations in vitro. Curr. Biol. 27, 705-713.
- Pathan-Chhatbar S. et al. 2018. Three mammalian tropomyosin isoforms have different regulatory effects on nonmuscle myosin-2B and filamentous b-actin in vitro. J. Biol. Chem. 293, 863-875.
- Stehn J.R. et al. 2013. A novel class of anticancer compounds targets the actin cytoskeleton in tumor cells. Cancer Res. 73, 5169-5182.
- Coombes J.D. et al 2015. Ras transformation overrides a proliferation defect induced by Tpm3.1 knockout. Cell. Mol. Biol. Lett. 20, 626-646.
- Currier M.A. et al. 2017. Identification of cancer-targeted tropomyosin inhibitors and their synergy with microtubule drugs. Mol. Cancer Ther. 16, 1555-1565.
- Kee A.J. et al. 2018. On-target action of anti-tropomyosin drugs regulates glucose metabolism. Sci. Rep. 8, 4604.
Actin Biochem Kits
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Actin Binding Protein Spin-down Biochem Kit (for muscle) |
CYT | BK001 | 1 KIT [30-100 assays] |
¥254,000 |
Actin Polymerization Biochem Kit, Rabbit |
CYT | BK003 | 1 KIT [30-100 assays] |
¥288,000 |
Actin Binding Protein Spin-Down Biochem Kit (Non-muscle) |
CYT | BK013 | 1 KIT [30-100 assays] |
¥257,000 |
G-Actin : F-Actin In Vivo Assay Kit, Mouse |
CYT | BK037 | 1 KIT [30-100 assays] |
¥250,000 |
Actin Live Cell Imaging Probes
[商品詳細]
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
SiR-Actin Kit |
CYT | CY-SC001 | 1 KIT [50-300 slides] |
¥180,000 |
SiR700-Actin Kit |
CYT | CY-SC013 | 1 KIT [35-200 slides] |
¥180,000 |
Cytoskeleton Kit (SiR-Actin + SiR-Tubulin) |
CYT | CY-SC006 | 1 KIT [50-300 slides] |
販売終了 |
Labeled Actin Proteins
[商品詳細]
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Actin Protein (biotin, skeletal muscle), Rabbit, Biotin |
CYT | AB07-A | 5*20 UG |
¥113,000 |
Actin Protein (biotin, skeletal muscle), Rabbit, Biotin |
CYT | AB07-C | 20*20 UG |
¥326,000 |
Actin Protein (pyrene, skeletal muscle), Rabbit |
CYT | AP05-A | 1*1 MG |
¥69,000 |
Actin Protein (pyrene, skeletal muscle), Rabbit |
CYT | AP05-B | 5*1 MG |
¥324,000 |
Actin Protein (rhodamine, platelet non-muscle), Human, Rhodamine Isothiocyanate |
CYT | APHR-A | 4*10 UG |
¥101,000 |
Actin Protein (rhodamine, platelet non-muscle), Human, Rhodamine Isothiocyanate |
CYT | APHR-C | 20*10 UG |
¥321,000 |
Actin Protein (rhodamine, skeletal muscle), Rabbit, Rhodamine Isothiocyanate |
CYT | AR05-B | 10*20 UG |
¥98,000 |
Actin Protein (rhodamine, skeletal muscle), Rabbit, Rhodamine Isothiocyanate |
CYT | AR05-C | 20*20 UG |
¥189,000 |
Unlabeled Actin Proteins
[商品詳細]
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する














