
記事ID : 11164
微小管内部の実体 CYTOSKELETON NEWS 2013年5月号

微小管内部の実体
微小管(MTs;Microtubules)は、細胞の成長、分裂、形態変化などにおいて、多数の機能をもつ、ダイナミックな細胞骨格構造です。今回のレビューでは、微小管の内腔の機能的実体の可能性にフォーカスします。微小管の内部環境は、独特な生物物理学的状況になっており、側部の2nm2の孔1と末端の200nm2の入り口部分2,3を除き、細胞質の影響から遮断されていると考えられています。その生物物理学的な状態は、本稿の範囲外ですが、非常に興味深い特性(硝子体特性、電磁共鳴特性、光学特性)を持っています4。
微小管内部はどうなっているかという考察は、いくつかのグループによって展開されてきました。1960年代から1970年代に、電子顕微鏡でnmレベルの解像度で微小管の構造が研究されたことが、これらの新発見の始まりです。高度に固定された細胞の微小管内腔で、4-7nmの球状粒子が存在する証拠が発見されました5-8。粒子の存在と頻度は、細胞の種類によって異なり、神経細胞で最も多く見つかりました。また、Burton9は、細胞内微小管の速やかな解体と集合によって、粒子が内腔から排出されることも発見しました。その後30年間の過程で、硝子体低温電子顕微鏡検査又は低温電子断層撮影10により、固定していない細胞の凍結切片でも、微小管内に粒子が観察され、同様の観察が数多く報告されました。腔内の構成成分を同定することは非常に困難ですが、最近の研究でチューブリン結合タンパク質やチューブリンを調節する酵素などが発見されています。
微小管アセチルトランスフェラーゼ(TAT;Tubulin acetyltransferase)は、アセチルCoAから微小管内腔のαチューブリンのLys40へアセチル基を転移することが知られています1,11。腔内のアセチル化は微小管の安定性には影響しないと考えられていますが、微小管関連タンパク質(MAPs;Microtubule-associated proteins)の結合性、キネシンモーターの親和性(微小管表面結合サイトを含む12,13、但し、この件については最近2つのグループで議論されています11,14)、微小管の切断15、機械感覚性や繊毛の機能に有用な微小管の堅さ16,17に関連しています。TAT及びチューブリンヒストン脱アセチル化酵素(HDAC6及びSirt2)が上述の4-7nmの粒子の構成成分であるかどうかは、まだ確認されていません。しかし、TATの単量体又は二量体は粒子内の空間を埋めることができ(TATは3×6×3nmの卵型18)、MEC-17(C. elegansのTATホモログ)が微小管腔内で局在化し、微小管内壁と密接に関連しているという証拠が見つかっています16。神経細胞のMAPであるTauも、微小管内腔で結合サイトを持っていることが知られています19。
タンパク質や粒子はどうやって微小管内腔に入るのでしょうか?微小管には最初の段落で述べたように明らかな入り口(2nm2の孔と200nm2の末端)があります。しかし、どちらも限界があり、2nm2の孔からは、1000Da未満小分子20,21又は繊維状の分子しかアクセスできず、微小管末端からのアクセスは拡散によって分子が移動できる距離に限定されます22。微小管の中央部分は末端から40μm以上離れており、50kDaのタンパク質を末端に入れた場合の拡散率を理論的に計算すると、40μmの移動にかかる時間は、分子の微小管内壁との親和性に依存して、1分から1年まで幅があります22。上記ほど明確ではない入り口として、末端のほつれ10,23、トレッドミル状態の微小管との結合部の成長末端24,25、微小管の格子のすきま(硝子体低温電子顕微鏡によって最近確認されたもの17)があります(図1)。
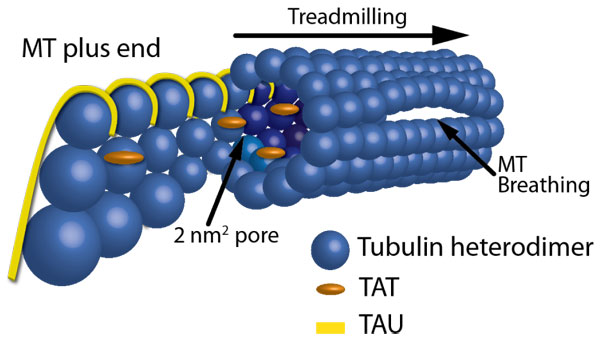
図1 微小管内腔への入り口
明確でない入り口のうち、成長中又は短縮中の微小管で、不規則な、又はほつれた末端がin vitroで観察されていましたが、最近硝子体低温電子顕微鏡10や、デジタル蛍光顕微鏡23によってin vivoでも観察されるようになってきました。原線維が微小管のプラス末端にさらされると、微小管内腔が更に暴露され、腔内にタンパク質や粒子を送り込む際の捕捉点として機能する可能性があります。その後のトレッドミルにより、捕捉された物体は60μm/分の速度でマイナス末端へ移動することが可能になります25。このことは、tau存在下で微小管が形成される場合には、MAP tauが微小管の表面と同程度に微小管内腔にも結合サイトを持っている一方で、既に形成された微小管にtauを添加しても微小管の外表面にしかtauが結合しない19ことを説明するメカニズムの1つである可能性があります。このように、微小管内に捕捉される分子を示すための実験では、既に形成された微小管を用いるよりも、チューブリンを重合化させる反応の方が分子を取り込みやすいことがわかりました(例:品番BK029とT240のデータシートのメソッドを比較してみてください)。
要約すると、いくつかの最近の主要な研究は、微小管内には、アセチル化チューブリン、TAT、微小管安定化剤(MSAs;MT stabilizing agent、例:タキソール、ラウリマリド、ペロルシド)の結合サイト、tauタンパク質などを含む重要な分子が存在していることを示しています。このような並外れた生物物理学的な特性に加えて、最近Sahuら4によって報告された観察は、微小管内部の実体が微小管表面と同様に興味深いことを示しています。
参考文献
1. Nogales et al. 1998. Structure of the alpha beta tubulin dimer by electron crystallography. Nature. 391, 199-203.
2. Gonzales and Robbins. 1965. The homology of spindle and tubules and neurotubules in chick embryo retina. Protoplasma. 59, 377-391.
3. Bassot and Martoja. 1966. Donnees histologiques at ultrastructurales sur les microtubules cytoplasmiques du canal ejaculateur des insects orthopteres. Z. Zelforsch. 74, 145-181.
4. Sahu et al. 2013. Atomic water channel controlling remarkable properties of a single brain microtubule: Correlating single protein to its supramolecular assembly. Biosens. Bioelectron. 47, 141-148.
5. Dustin. 1978. Microtubules. Spring-Verlag, Heidelberg. 33.
6. Echandia et al. 1968. Dense core microtubules in neurons and gliocytes of the toad Bufo arenarum Hensel. Am. J. Anat. 122, 157-168.
7. Peters et al. 1968. The small pyramidal neuron of the rat cerebral cortex. The axon hillock and initial segment. J. Cell. Biol. 39, 604-619.
8. Stanley et al. 1972. Fine structure of normal spermatid differentiation in Drosophila melanogastor. J. Ultrastruc. Res. 41, 433-466.
9. Burton. 1984. Luminal material in microtubules of frog olfactory axons: Structure and distribution. J. Cell. Biol. 99, 520-528.
10. Garvalov et al. 2006. Luminal particles within cellular microtubules. J. Cell Biol. 174, 759-765.
11. Soppina et al. 2012. Luminal localization of alpha-tubulin K40 acetylation by cryo-EM analysis of Fab-labeled microtubules. PLoS ONE. 7, 1-9.
12. Dompierre et al. 2007. Histone deacetylase 6 inhibition compensates for the transport deficit in Huntingdon’s disease by increasing tubulin acetylation. J. Neurosci. 27, 3571-3583.
13. Reed et al. 2006. Microtubule acetylation promotes kinesin-1 binding and transport. Curr. Biol. 16, 2166-2172.
14. Walter et al. 2012. Tubulin acetylation alone does not affect kinesin-1 velocity and run length in vitro. PLoS ONE 7:e42218. doi:10.1371 / journal.pone.0042218.
15. Sudo and Bass. 2010. Acetylation of microtubules influences their sensitivity to severing by katanin in neurons and fibroblasts. J. Neurosci. 30, 7215-7226.
16. Topalidou et al. 2012. Genetically separable functions of the MEC-17 tubulin acetyltransferase affect microtubule organization. Curr. Biol. 22, 1057-1065.
17. Cueva et al. 2012. Posttranslational acetylation of alpha-tubulin constrains protofilament number in native microtubules. Curr. Biol. 22, 1066-1074.
18. Kormendi et al. 2012. Crystal strucuture of tubulin acetyltransferase reveal a conserved catalytic core and the plasticity of the essential N terminus. J. Biol. Chem. 287, 41569-41575.
19. Kar et al. 2003. Repeat motifs of tau bind to the insides of microtubules in the absence of taxol. EMBO J. 22, 70-77.
20. Maccari et al. 2013. Free energy profile and kinetics studies of paclitaxel internalization from the outer to the inner wall of microtubules. J. Chem. Theory Comput. 9, 698-706.
21. Ross and Fygenson. 2003. Mobility of taxol in microtubules bundles. Biophys. J. 84, 3959-3967.
22. Odde. 1998. Diffusion inside microtubules. Eur. Biophys. J. 27, 514-520.
23. Demchouk et al. 2011. Microtubule tip tracking and tip structures at the nanometer scale using digital fluorescence microscopy. Cell Mol. Bioeng. 4, 192-204.
24. Hotani and Horio. 1988. Dynamics of microtubules visualized by darkfield microscopy: treadmilling and dynamic instability. Cell Motil. Cytoskel.(now Cytoskeleton). 10, 229–236.
25. Waterman-Storer and Salmon. 1997. Microtubule dynamics: Treadmilling comes around again. Curr. Biol. 7, R369–R372.
26. Field et al. 2013. The binding sites of microtubule-stabilizing agents. Chem. Biol. 20, 301-315.
微小管関連ツール タンパク質
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Pre-formed Microtubles, Porcine |
CYT | MT002-A | 4*500 UG |
¥144,000 |
Tubulin (porcine brain, >99% pure), Porcine |
CYT | T240-A | 1*1 MG |
¥41,000 |
Tubulin (porcine brain, >99% pure), Porcine |
CYT | T240-B | 5*1 MG |
¥189,000 |
Tubulin (HTS format), Porcine |
CYT | HTS03-A | 1*4 MG [8 assays] |
CYT社 HTS03A 2*4 を参照 |
Tubulin (HTS format), Porcine |
CYT | HTS03-B | 1*40 MG [96 assays] |
お問い合わせ |
微小管関連ツール キット
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Tubulin Polymerization Assay Kit |
CYT | BK006P | 1 KIT [24 assays] |
¥298,000 |
Tubulin Polymerization Assay Kit, Porcine |
CYT | BK004P | 1 KIT [24 assays] |
¥209,000 |
Tubulin Polymerization Assay |
CYT | BK011P | 1 KIT [96 assays] |
¥302,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













