記事ID : 14058
アルギニンの正電荷を消失させるシトルリン化 CYTOSKELETON NEWS 2014年10月号

アルギニンの正電荷を消失させるシトルリン化
タンパク質のシトルリン化(脱イミノ化)は、アルギニンがシトルリンに変換される新しい翻訳後修飾(PTM)で、目的タンパク質に重要な変化をもたらします。ペプチジルアルギニンデイミナーゼ(PADs)は、カルシウム依存的な脱イミノ化を介してアルギニン側鎖のグアニジノ基をウレイド基に変換し、非標準アミノ酸であるシトルリンを形成します(図1参照)。PAD アイソフォームは5種類(PAD1-4、PAD6)存在し、重要な配列相同性を共有していますが、主に組織特異的発現に違いが見られます1。PADs は、タンパク質のアルギニン側鎖の修飾に重要な役割を果たす遊離L-アルギニンを、脱イミノ化することはできません2。現在のところ、逆反応を行う酵素は同定されていません。
タンパク質のアルギニン側鎖が脱イミノ化されることで、目的タンパク質の正電荷が減少し、局所的な疎水性が増大します。タンパク質のシトルリン化は、タンパク質のアンフォールディング3、タンパク質間、または、タンパク質と他の細胞成分との相互作用の減少4、他のシグナル伝達イベント(例: アルギニンのメチル化5,6)との干渉、免疫応答や自己免疫を誘発する新規の抗原エピトープの形成7 などにつながります。
シトルリン化は、タンパク質の機能にネガティブな影響を与えるように見えますが、生理学的には重要なプロセスであると言えます。シトルリン化されたタンパク質は、分化、神経成長、胚発生、細胞死、遺伝子調節において重要な役割を果たします8。PAD によってシトルリン化されることが知られているタンパク質には、生物学的に関連のある、ケラチン、フィラグリン、トリコヒアリン、ビメンチン、ミエリン塩基性タンパク質(MBP)、ヒストン、α-エノラーゼ、フィブリノーゲン、フィブリン、I型/II型コラーゲン、β-アクチン、チューブリンなどがあります9-11。興味深いことに、これらの中には、細胞骨格や構造の一部であるタンパク質が多く含まれています。
タンパク質の異常なシトルリン化は、多発性硬化症、アルツハイマー病、慢性関節リウマチ(RA)、乾癬、プリオン病、肝線維症、慢性閉塞性肺疾患(COPD)、癌などの、様々な疾患に関連しています8,12,13。これらの、全てではありませんが、ほとんどが炎症性疾患であり、炎症において PAD が重要な働きをしていることと一致しています14。RA では、関節炎の関節滑液中で特異的にシトルリン化されるタンパク質がいくつか同定されており10、その多くは上述した通りです。これらのタンパク質がシトルリン化されると、自己抗体を産生する新規エピトープとなり7、得られた抗シトルリン化タンパク質抗体(ACPAs)は、RA の標準的な診断および予後の指標となります15-17。Circulating ACPAs は、RA の他の症状の前に現れることが多く、疾患の初期徴候、重度の関節損傷、心血管合併症の高い発症リスクと関連しています15-17。
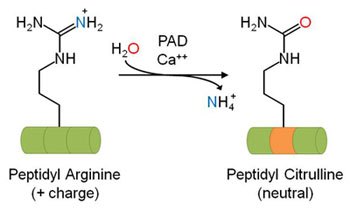
図1 ペプチジルアルギニンデアミナーゼ(PADs)によるアルギニンのシトルリン化
ビメンチンは中間径フィラメント(IF)を構成するタンパク質で、RA に関連するシトルリン化タンパク質の一つです18。ビメンチン細胞骨格は、細胞および組織の完全性の維持、細胞の接着や移動、多くの細胞シグナル伝達イベントなどにおいて不可欠です19。シトルリン化ビメンチンは、RA 患者の滑液中で ACPAs の産生を誘発する、重要な働きを担っていると考えられています20。さらに、シトルリン化ビメンチンに対して産生された自己抗体は、破骨細胞形成を介した骨損失を直接誘導することが示されています21。ビメンチンのシトルリン化は、PAD2 を介すると考えられており、シトルリン化によってビメンチンの正常な機能が損なわれると、フィラメントが不安定化し、in vitro における重合能が失われ、細胞内のビメンチン細胞骨格の崩壊につながります4,22。また、それとは逆に、シトルリン化ビメンチンは、活性化Tリンパ球内で PAD2 によって誘導されるアポトーシスに能動的な役割を有することが示されています23。RA患者の滑液(SF)中で実際に免疫細胞のアポトーシスが起こることはわかっていますが、「通常は細胞内にあるビメンチンが細胞外に露出し、自己免疫応答を誘発する可能性」のようなアポトーシスが自己免疫応答の前段階であるかどうかを解明するため、さらなる研究が必要とされています。
第一、第二世代 PAD 阻害剤は、タンパク質のシトルリン化が重要となる疾患のモデル動物を用いた前臨床試験で、有望な結果を得られています24。今後、PAD 阻害剤の研究が進展し、ヒト臨床試験に移行できるような効力・選択性・薬理作用を持つ阻害剤が開発されることが期待されます。
参考文献
1. E.R. Vossenaar et al. 2003. PAD, a growing family of citrullinating enzymes: genes, features and involvement in disease. Bioessays. 25, 1106-1118.
2. H. Takahara et al. 1986. Calcium-dependent properties of peptidylarginine deiminase from rabbit skeletal muscle. Agric. Biol. Chem. 50, 2899-2904.
3. E. Tarcsa et al. 1996. Protein unfolding by peptidylarginine deiminase. Substrate specificity and structural relationships of the natural substrates trichohyalin and filaggrin. J. Biol. Chem. 271, 30709-30716.
4. M. Inagaki et al. 1989. Ca2+-dependent deimination-induced disassembly of intermediate filaments involves specific modification of the amino-terminal head domain. J. Biol. Chem. 264, 18119-18127.
5. Y. Wang et al. 2004. Human PAD4 regulates histone arginine methylation levels via demethylimination. Science. 306, 279-283.
6. G.L. Cuthbert et al. 2004. Histone deimination antagonizes arginine methylation. Cell. 118, 545-553.
7. G.A. Schellekens et al. 1998. Citrulline is an essential constituent of antigenic determinants recognized by rheumatoid arthritis-specific autoantibodies. J. Clin. Invest. 101, 273-281.Z.
8. Baka et al. 2012. Citrullination under physiological and pathological conditions. Joint Bone Spine. 79, 431-436.
9. K. Conrad et al. 2010. Profiling of rheumatoid arthritis associated autoantibodies. Autoimmun. Rev. 9, 431-435.
10. J.J. van Beers et al. 2013. The rheumatoid arthritis synovial fluid citrullinome reveals novel citrullinated epitopes in apolipoprotein E, myeloid nuclear differentiation antigen, and β-actin. Arthritis Rheum. 65, 69-80.
11. Z. Jiang et al. 2013. Investigating citrullinated proteins in tumour cell lines. World J. Surg. Oncol. 11, 260.
12. S. Abdeen et al. 2011. Serum anti-modified citrullinated vimentin antibody concentration is associated with liver fibrosis in patients with chronic hepatitis. Hepat Med. 3, 13-18.
13. B. Jang et al. 2013. Peptidylarginine deiminase and protein citrullination in prion diseases: strong evidence of neurodegeneration. Prion. 7, 42-46.
14. D. Makrygiannakis et al. 2006. Citrullination is an inflammation-dependent process. Ann. Rheum. Dis. 65, 1219-1222.
15. W.J. van Venrooij et al. 2002. Anticitrullinated protein/peptide antibody and its role in the diagnosis and prognosis of early rheumatoid arthritis. Neth. J. Med. 60, 383-388.
16. E.J. Kroot et al. 2000. The prognostic value of anti-cyclic citrullinated peptide antibody in patients with recent-onset rheumatoid arthritis. Arthritis Rheum. 43, 1831-1835.
17. O. Meyer et al. 2003. Anticitrullinated protein/peptide antibody assays in early rheumatoid arthritis for predicting five year radiographic damage. Ann. Rheum. Dis. 62, 120-126.
18. E.R. Vossenaar et al. 2004. Rheumatoid arthritis specific anti-Sa antibodies target citrullinated vimentin. Arthritis Res. Ther. 6, R142-R150.
19. J. Ivaska et al. 2007. Novel functions of vimentin in cell adhesion, migration, and signaling. Exp. Cell Res. 313, 2050-2062.
20. K. Van Steendam et al. 2011. The relevance of citrullinated vimentin in the production of antibodies against citrullinated proteins and the pathogenesis of rheumatoid arthritis. Rheumatology. 50, 830-837.
21. U. Harre et al. 2012. Induction of osteoclastogenesis and bone loss by human autoantibodies against citrullinated vimentin. J. Clin. Invest. 122, 1791-1802.
22. I. Hojo-Nakashima et al. 2009. Dynamic expression of peptidylarginine deiminase 2 in human monocytic leukaemia THP-1 cells during macrophage differentiation. J. Biochem. 146, 471-479.
23. P.C. Hsu et al. 2014. Vimentin is involved in peptidylarginine deiminase 2-induced apoptosis of activated Jurkat cells. Mol. Cells. 37, 426-434.
24. K.L. Bicker and P.R. Thompson. 2013. The protein arginine deiminases: Structure, function, inhibition, and disease. Biopolymers. 99, 155-163.
アクチン タンパク質/抗体
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Actin protein (rabbit skeletal muscle, >99% pure), Rabbit, Unlabeled |
CYT | AKL99-A | 4*250 UG |
¥68,000 |
Actin protein (rabbit skeletal muscle, >99% pure), Rabbit, Unlabeled |
CYT | AKL99-B | 2*1 MG |
¥81,000 |
Actin protein (rabbit skeletal muscle, >99% pure), Rabbit, Unlabeled |
CYT | AKL99-C | 5*1 MG |
¥166,000 |
Actin protein (rabbit skeletal muscle, >99% pure), Rabbit, Unlabeled |
CYT | AKL99-D | 10*1 MG |
¥318,000 |
Actin protein (rabbit skeletal muscle, >99% pure), Rabbit, Unlabeled |
CYT | AKL99-E | 20*1 MG |
お問い合わせ |
Actin Protein (skeletal muscle, >95% pure), Rabbit, Unlabeled |
CYT | AKL95-B | 1*1 MG |
¥32,000 |
Actin Protein (skeletal muscle, >95% pure), Rabbit, Unlabeled |
CYT | AKL95-C | 5*1 MG |
¥128,000 |
Actin Protein (platelet non-muscle, >99% pure), Human, Unlabeled |
CYT | APHL99-A | 2*250 UG |
¥74,000 |
Actin Protein (platelet non-muscle, >99% pure), Human, Unlabeled |
CYT | APHL99-C | 1*1 MG |
¥125,000 |
Actin Protein (platelet non-muscle, >99% pure), Human, Unlabeled |
CYT | APHL99-E | 5*1 MG |
お問い合わせ |
Actin Protein, smooth muscle, >99% pure |
CYT | AS99-A | 1*1 MG |
¥40,000 |
Actin Protein, smooth muscle, >99% pure |
CYT | AS99-B | 5*1 MG |
¥171,000 |
Actin Protein (cardiac muscle, >99% pure), Bovine, Unlabeled |
CYT | AD99-A | 1*1 MG |
¥40,000 |
Actin Protein (cardiac muscle, >99% pure), Bovine, Unlabeled |
CYT | AD99-B | 5*1 MG |
¥171,000 |
Anti Actin w/positive control, Human (Rabbit) Unlabeled |
CYT | AAN01-B | 3*100 UG |
販売終了 |
チューブリン タンパク質/抗体
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Tubulin (porcine brain, >99% pure), Porcine |
CYT | T240-A | 1*1 MG |
¥41,000 |
Tubulin (porcine brain, >99% pure), Porcine |
CYT | T240-B | 5*1 MG |
¥189,000 |
Tubulin (porcine brain, >99% pure), Porcine |
CYT | T240-C | 20*1 MG |
お問い合わせ |
Anti Tubulin w/o positive control (Sheep) Unlabeled |
CYT | ATN02-B | 6*100 UG |
販売終了 |
アセチルリジン マウスモノクローナル抗体
- アセチルリジン マウスモノクローナル抗体
- 翻訳後修飾されたアセチル化リジンを幅広く検出
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti Acetyl Lysine (Trial size), (Mouse) , 3C6.08.20 |
CYT | AAC01-S | 25 UL [1 x 25 μl] |
¥34,000 |
Anti Acetyl Lysine, (Mouse) , 3C6.08.20 |
CYT | AAC01 | 200 UL [2 x 100 μl] |
¥125,000 |
ビメンチン タンパク質
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Vimentin, Syrian Hamster |
CYT | V01-A | 2*50 UG |
販売終了 |
Vimentin, Syrian Hamster |
CYT | V01-C | 10*50 UG |
販売終了 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













