記事ID : 12010
ダイニン:チームとして強力に作用するモータータンパク質 CYTOSKELETON NEWS 2013年11月/12月号

ダイニン:チームとして強力に作用するモータータンパク質
真核細胞において、微小管(MT)のマイナス端に向かって物質を輸送させることが知られているモータータンパク質は、細胞質ダイニン複合体(CDC;cytoplasmic dynein complex)及びキネシン-14ファミリーメンバーだけです1。この機能は、細胞の代謝、構造、移動にとって非常に重要です。これらのプロセスの大部分はCDCの高い忠実度及び安定した進行性の運動を利用しています。CDCの幅広い役割は印象的で、さらに輸送物質又は細胞内の位置を選択する補助的なタンパク質としても定義されます。これらのプロセスの多様な例として、a)ニューロンの樹状突起への物質輸送2、b)有糸分裂染色体運動3、c)アポトーシスへのプレカスパーゼ経路4、d)ミトコンドリアの運動及び分裂5、e)アミロイド前駆タンパク質の小胞輸送6、などがあげられます。同様に、これらの機能の補助的なタンパク質には様々なものがあり、ほんの少し例を挙げると、プレセニリン、LIS1、NUDEL、NuMA、ダイナクチン接着p150、Miro、Milton、BimL、BimELなどがあります。
興味深いことに、CDCのモータードメインの構造は、実際のメカニズムを表すかのように、ねじれギアのようなデザインになっています7(図1)。各ダイニン分子は、6つのドメインのリングモーターヘッド、輸送物質に結合する20nmのコイルドコイルアミノ末端尾部、末端に小さいMT結合ドメインを持つ9nmのコイルドコイル首部から成ります。リングの6つのドメインには、最大で4つのATP分子が結合し、そのうち1つはパワーサイクルにATPを加水分解し、残りの3つはレギュレーター又はスイッチとして機能するために平衡化しています。5番目、6番目のドメインは、アデニン結合モチーフ(P-ループ)を持たないため、ATPは結合できません。ねじれギア機構は、6つのドメインが、低負荷では膨張され、高負荷では圧縮されることによって起こっていると考えられます。更により高い負荷では、CDCがMT表面上で横になり、プラス端への移動を止めるcatch-bondを形成します。
MT上を移動するためのモーターに利用される機構には、シングルヘッドの1ステップ、ダブルヘッドの複数ステップ、スタッターステップ、線形拡散などいくつかあります8-10。最もよく知られているのは、キネシン重鎖(KHC、キネシン-1のサブファミリー)や細胞質ミオシンのような、ダブルヘッドモータータンパク質の複数ステップです。これらのモーターは、スピードやギアのコントロールなしに動き、CDCと比べて同程度の仕事量で、しばしばMTから外れます。対照的に、CDCは、例えば、in vitroにおいて24-36nm程度ステップ移動しますが、これはチューブリンヘテロダイマーの3つから4つ分の長さに相当します11。CDCが9nmのスペーサー距離(MTに対するモーター)を持つ二量体として存在することから考えると、この距離は驚異的ですが、モータードメインが、ミオシンやキネシンのように互いに密接に結合はしておらず、輸送物質を結合している部位から考えると、そのスペーサー距離は更に15nm長くなります(図1)。in vitroでは、輸送物質が細胞マトリクスに引きずられることがなく、モーターにかかる負担は大きくありません。in vivoでは、CDCの動きは大きく異なり、負荷状態では移動距離は8nm(チューブリンヘテロダイマー1つ分の長さに相当)に減少します12。このように、CDCは、負荷状態によってそのステップサイズを変化させ、MTとのコンタクトを維持します。
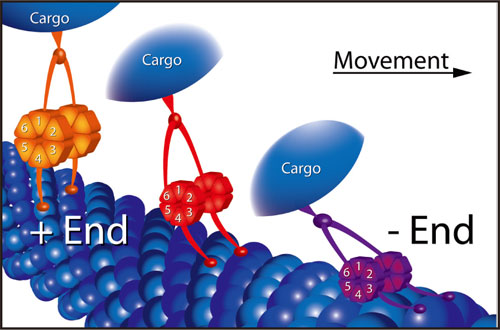
図1 ねじれギアメカニズムと微小管(MT)の「catch-bond」の模式図
CDCの6つのモータードメインを、オレンジ(緩和状態)、又は赤(高負荷で圧縮された状態)で示す。また、更に高い負荷で、MT上に圧縮された状態を紫で示す。
近年、いくつかの研究グループの生細胞を用いた精巧な顕微鏡観察により、ダイニンがin vivoでどのように動き、そのコントロールを維持しているかが明らかになりました11-15。これらのグループは、初期の研究を以下のように改良しました。
a)移動距離を測定するために、レーザーに捕捉された小胞を利用、b)データを直線軌跡(<5%角度)に限定、c)一方向への失速及び走行を正確に定義、d)互いに負に作用する対立するモーターの指標として失速した小胞の幅を測定、e)均一なモータータンパク質構成(KHC及びCDCのみ)を示す、遅いエンドソーム小胞を利用
in vivoでMTマイナス端へ移動する小胞が観察された場合、その小胞はプラス端方向にも移動したり、立ち往生したりもします。実際には、小胞の運動が、KHCによるものからCDCによるものに変化し、後退します。この概要は、直感的なものではなく、CDCの存在だけを期待するかもしれません。Mallikのグループは、この動きを詳細に研究し、動く小胞で生じる力を算出するために、レーザートラップを利用しました12。大部分のケースで、プラス端方向(KHC)へ5-6ピコニュートン(pN)、マイナス端方向(CDC)へ5-8pNの動力が測定されました。in vitroでの測定から、この動力は、KHCダイマー1つとCDC複合体5-10個が存在していることを反映しています。測定を実行してからの運動の長さは、5:1の比率(6nm CDC/1.2nm KHC)で、マイナス端方向に優位に動いています。更に、失速後の速度とステップサイズは、両方ともCDCのマイナス端方向が、1.5-2.0倍高く測定されました。これらの見地は全て、マイナス端方向への動きを産出するように組み合わされています。筆者らは、ダイニンは、各分子が1pNの力に寄与し、それらがチームとして強力に機能するという結論でまとめ、ダイニンがMTとcatch-bondを形成し、プラス端方向への移動を妨げるという見解に広げました16。
要約すると、ダイニンは、進化的にユニークな、機械化学的なギアモーターで、複数のモーターの効果を組み合わせることで、強力な動力をもたらします。また、MTと強力にcatch-bondを形成し、KHCモーターと逆の動力を持ちます。サイトスケルトン社では、低負荷及び高負荷のMT刺激CDC ATPaseアッセイを開発しました。これにより、Firestoneらの報告17のようなインヒビターやエンハンサーの同定が可能です。ダイニンも、製法をカスタマイズしたタンパク質として提供可能です。詳細はお問い合わせください。
参考文献
1. Paschal B.M. & Vallee R.B. 1987. Isolated flagellar outer arm dynein translocates brain microtubules in vitro. Nature. 330, 672-674.
2. Sasaki S. et al. 2000. A LIS1/NUDEL/cytoplasmic dynein heavy chain complex in the developing and adult nervous system. Neuron. 28, 681-696.
3. Merdes A. et al. 1996. A complex of NuMA and cytoplasmic dynein is essential for mitotic spindle assembly. Cell. 87, 447-458.
4. Puthalakath H. et al. 1999. The proapoptotic activity of the Bcl-2 family member Bim is regulated by interaction with dynein motor complex. Mol. Cell. 3, 287-296.
5. Schwarz T.L. 2013. Mitochondrial trafficking in neurons. Cold Spring Harb. Perspect. Biol. doi 10.1101/cshperspect.a011304.
6. Gunawardena S. et al. 2013. Presenilin controls kinesin-1 and dynein function during APPvesicle transport in vivo. Hum. Mol. Genet. 22, 3828-2843.
7. Vallee R.B. et al. 1988. Microtubule-associated protein 1C from brain is a two-headed cytosolic dynein. Nature. 332, 561-563.
8. Hirokawa N. 1998. Kinesin and dynein superfamily proteins and the mechanism of organelle transport. Science. 279, 519-526.
9. Kull F.J. & Endow S.A. 2013. Force generation by kinesin and myosin cytoskeletal motor proteins. J. Cell Sci. 126, 9-19.
10. Vallee R.B. et al. 2012. Multiple modes of cytoplasmic dynein regulation. Nat. Cell Biol. 14, 224-230.
11. DeWitt M.A. et al. 2012. Cytoplasmic dynein moves through uncoordinated stepping of AAA+ ring domains. Science. 335, 221-225.
12. Rai A.K. et al. 2013. Molecular adaptations allow dynein to generate large collective forces inside cells. Cell. 152, 172-182.
13. Soppina V. et al. 2009. Tug-of-war between dissimilar teams of microtubule motors regulates transport and fission of endosomes. Proc. Natl. Acad. Sci. U.S.A. 106, 19381- 19386.
14. Qiu W. et al. 2012. Dynein achieves processive motion using both stochastic and coordinated stepping. Nat. Struct. Mol. Biol. 19, 193-200.
15. Dufrene Y.F. et al. 2011. Five challenges to bringing single-molecule force microscopy into live cells. Nat. Methods. 8, 123-127.
16. Kunwar A. et al. 2011. Mechanical stochastic tug-of-war models cannot explain bidirectional lipid droplet transport. Proc. Natl. Acad. Sci. U.S.A. 108, 18960-18965.
17. Firestone A.J. et al. 2012. Small molecule inhibitors of AAA+ ATPase motor cytoplasmic dynein. Nature. 484, 125-129.
モータータンパク質
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Dynein (Cytoplasmic), Porcine |
CYT | CS-DN01 | 1*50 UG |
¥153,000 |
MKLP2 motor domain (human recombinant), Human |
CYT | CS-MP05 | 1*50 UG |
CYT社 CSMP05A 1*50 を参照 |
KIF7 motor domain, Human |
CYT | CS-KF51 | 1*100 UG |
¥150,000 |
Myosin S1 Fragment (Cardiac), Bovine |
CYT | CS-MYS03 | 1*250 UG |
¥116,000 |
Skeletal Muscle Myosin S1, Rabbit |
CYT | CS-MYS04 | 1*250 UG |
¥120,000 |
Myosin S1 Fragment (smooth), Chicken |
CYT | CS-MYS05 | 1*250 UG |
¥120,000 |
| Myosin S1 Fragment (non-muscle), Bovine | CYT | CS-MYS06 | 1 EACH [1 x 250 μg] |
販売終了 |
Lyophilized Thin Filaments, Bovine |
CYT | CS-TFC01 | 1 MG [1 x 1 mg] |
販売終了 |
Tropomyosin/Troponin Complex, Bovine |
CYT | CS-TT05 | 1 MG [1 x 1 mg] |
CYT社 CSTT05A 1*1 を参照 |
CENP-E Motor domain (Hm.sap.) |
CYT | CP01-A | 2*25 UG |
¥150,000 |
Chromokinesin Motor Domain (Hm.sap.) |
CYT | CR01-A | 2*25 UG |
¥150,000 |
Eg5 Motor Domain (Hm.sap.) |
CYT | EG01-A | 2*25 UG |
¥150,000 |
BimC Motor Domain |
CYT | BM01-A | 2*25 UG |
¥133,000 |
Eg5 Homolog BimC Motor Domain Protein |
CYT | EG02-A | 2*15 UG |
¥137,000 |
KIFC3 Motor Domain (Hm.sap) |
CYT | KC01-A | 2*25 UG |
¥150,000 |
KIF3C Motor Domain (Hm.sap.) |
CYT | KF01-A | 2*25 UG |
¥150,000 |
KHC Motor Domain (Hm.sap.) |
CYT | KR01-A | 2*25 UG |
¥150,000 |
MCAK Motor Domain (Hm.sap.) |
CYT | MK01-A | 2*25 UG |
¥150,000 |
MKLP Motor Domain (Hm.sap.) |
CYT | MP01-A | 2*25 UG |
¥150,000 |
Pre-formed Microtubles, Porcine |
CYT | MT002-A | 4*500 UG |
¥153,000 |
Pre-formed Microtubles, Porcine |
CYT | MT002-XL | 1*10 MG |
お問い合わせ |
Pre-formed actin filaments (rabbit skeletal muscle), Rabbit |
CYT | AKF99-A | 1*1 MG |
¥69,000 |
Pre-formed actin filaments (rabbit skeletal muscle), Rabbit |
CYT | AKF99-B | 5*1 MG |
¥240,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













