E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
CYTOSKELETON NEWS 2017年7月号

E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
E3ユビキチンリガーゼ(Mdm2: murine double minute 2; ヒト相同体, Hdm2)は、その発がん性活性でよく知られ、強力な腫瘍抑制因子p53の主要な制御因子です1,2。さらに、Mdm2はp53非依存的な発がん性タンパク質としても機能すると考えられています3。Mdm2は2つの経路を通じてp53による遺伝子発現を抑制することができます。一つはp53への直接結合による転写活性抑制、もう一つは自身のE3リガーセ活性を介したユビキチン媒介型分解です4。しかしながら、Mdm2の直接結合によるp53抑制の有効性は疑問視されています5。
正常なストレスのない状況下では、Mdm2はp53のアポトーシス/細胞死転写活性をしっかりと制御するため、p53発現と活性を最低レベルに維持しています。細胞ストレス下では、Mdm2によるp53のユビキチン化が停止し、p53がアポトーシス遺伝子や細胞成長阻害に関与する遺伝子の転写を活性化できます。数々の研究において、この事象はMdm2の自己ユビキチン化による自己阻害によるものであると結論付けられています。しかしながら、この説は当初考えられていたものよりさらに複雑で 5、複数の翻訳後修飾(PTM)が関与していることが分かってきました。本稿では、ユビキチン化、SUMO化、リン酸化、およびアセチル化によるMdm2の制御に関して論じていきます6-8(図1)。
MDM2のユビキチン化とSUMO化
Mdm2は少なくとも部分的にMdm2自身によりユビキチン化され(自己ユビキチン化、ほとんどのE3リガーゼに共通)、その後、不安定化して分解されます1-3(図1)。しかし、Mdm2のE3ユビキチンリガーゼ活性は必ずしもMdm2分解に必要ないことから、自己ユビキチン化がMdm2分解の唯一の手段では無いことが示唆されます5。他にも、Mdm2をユビキチン化して安定性を制御するp300-CBP関連因子(PCAF)といったE3リガーゼ活性をもつ候補タンパク質が存在します9 。
Mdm2のポリユビキチン化により自身のE3リガーゼ活性が活性化され、この修飾によりp53のポリユビキチン許容量が著しく促進されるという報告があり、Mdm2活性制御におけるユビキチン化の役目はさらに複雑なものであるようです10。興味深いことに 、"モノ"ではなく"ポリ"ユビキチン化によりMdm2のE3リガーゼ活性が上方制御されています10。これらの知見より、自己ポリユビキチン化は分解の合図にすぎないという仮説が立てられました10。タンパク質はSUMO化により、安定性を変えたり、局在化したり、タンパク質間で相互作用をするようになったり、DNA結合/トランス活性化をするようになったりします11。 Mdm2はSUMO E3リガーゼであるUbc9、PIAS1、RanBP2によりSUMO1修飾を受けます12,13(図1)。核内移行にともない、Mdm2はRanBP2によりSUMO1修飾を受け、さらにPIASによりSUMO化され、これにより核内でp53が安定して豊富に存在するようになります13。紫外線照射でMdm2のSUMO化が減少することから分かるように、このSUMO修飾はストレスにより逆方向に起こるよう誘発されます12。 SUMO化されたMdm2は自己ユビキチン化を最小限に抑え、p53に対するE3リガーゼ活性を最大化させます12。これは、SUMOとユビキチン修飾が相互に排他的かつ競合的であるとのとの見解と一致します。
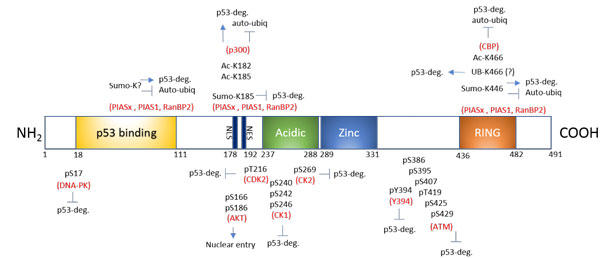
図1. Mdm2での翻訳後修飾
Mdm2は複数の部位修飾を経てp53への結合と、p53またはMdm2自身のプロテアソーム分解を制御する。
Acidic: 酸性ドメイン、Zinc: ジンクフィンガー、RING: RINGフィンガー、NLS: 核移行シグナル、NES: 核外移送シグナル
Mdm2の複数部位でのリン酸化
複数部位がリン酸化された Mdm2のアミノ酸は、およそ20%がセリンとスレオニン残基で構成されており、これらの多くが複数のキナーゼによりリン酸化されています(図1)。これらはN末端と中央ドメインの2つの全く異なる部位において重度にクラスター化されています14。Mdm2のリン酸化は主にp53との相互作用により微調整されています。毛細血管拡張性小脳失調症変異(ATM: Ataxia-talangiectasia mutated)キナーゼが媒介して、Mdm2のS395残基がリン酸化されることにより、Mdm2が不安定化され、p53分解が低減されます。一方で、PI3-K/Aktが媒介して、Mdm2のS166とS186残基がリン酸化されると、Mdm2は安定化し、p53は不安定化します3, 6, 15(図1)。遺伝毒性ストレスを受け、DNA依存性タンパク質キナーゼ(DNA-PK)がMdm2のS17残基がリン酸化されると、Mdm2からp53が引き離されます16。予想されたように、タンパク質脱リン酸化酵素1D (PPM1D:野生型p53誘導型脱リン酸化酵素1としても知られる)が媒介して、リン酸化されたS395が脱リン酸化されることでMdm2が安定化され、p53の分解が促進されます17(図1)。
Mdm2のアセチル化
さらにMdm2は、in vitroではCREB結合タンパク質(CBP)とp300によって、in vivoではCBPによって、アセチル化されます。このアセチル化はC末端RINGフィンガードメインにおいて主に生じます8,18。これらのデータより、アセチルトランスフェラーゼがMdm2を不活性化することで間接的に細胞内p53活性に対して正の制御を行っている可能性が示唆されます。p300によるin vitroでのアセチル化もまた、Mdm2の中央ドメイン(124-246アミノ酸)において生じます18。
最近、核移行シグナル内の2つのリジン残基 (K182とK185)におけるアセチル化が同定されました7(図1)。正常なストレスのない状況下では 、p300がMdm2のK182とK185をアセチル化することで、脱ユビキチン化酵素HAUSP(ヘルペスウイルス関連ユビキチン特異的タンパク質分解酵素)のMdm2への結合が促進されます。これらの修飾(アセチル化と、おそらく脱ユビキチン化)によりMdm2が安定化されて自己ユビキチン化から保護されますが、これはp53活性阻害が増大することと比例します。遺伝毒性によるストレスをかけると、脱アセチル化酵素SIRT1が活性化され、これら部位におけるSIRT1媒介型の脱アセチル化により、Mdm2の自己ユビキチン化が促進されてp53安定性が増し、続いてp53活性が増大します7,19。したがって、K182とK185におけるp300媒介型アセチル化とSIRT1 媒介型脱アセチル化により、Mdm2の機能の安定性が調節され(HAUSPの介助を得て)、p53活性を調節する分子スイッチとして機能します7(図1)。
まとめ
翻訳後修飾 (PTM) は、タンパク質の機能、局在、および安定性の調節因子としてよく知られています。Mdm2の場合では、ユビキチン化、SUMO化、リン酸化、およびアセチル化修飾により、それぞれ個別に、そして、お互いに応答し合ってMdm2の機能と安定性を制御しています。したがって、様々な種類や強度の細胞ストレスを受けて、p53が引き起こす細胞の生死を、Mdm2が正確かつ迅速にコントロールすることが可能となっています。
Cytoskeleton社では、神経生物学、心臓学、リウマチ科、および腫瘍学などの臨床分野に関係するタンパク質はもちろん、どんなタンパク質においても翻訳後修飾が担う役割を詳細に評価して分析できる様々なSignal Seeker™ツールをご用意しています。
- Karni-Schmidt O. et al. 2016. The roles of MDM2 and MDMX in cancer. Annu. Rev. Pathol. 11, 617-644.
- Wade M. et al. 2013. MDM2, MDMX and p53 in oncogenesis and cancer therapy. Nat. Rev. Cancer. 13, 83-96.
- Iwakuma T. and Lozano G. 2003. MDM2, an introduction. Mol. Cancer Res. 1, 993-1000.
- Momand J. et al. 1992. The mdm-2 oncogene product forms a complex with the p53 protein and inhibits p53-mediated transactivation. Cell. 69, 1237-1245.
- Itahana K. et al. 2007. Targeted inactivation of Mdm2 RING finger E3 ubiquitin ligase activity in the mouse reveals mechanistic insights into p53 regulation. Cancer Cell. 12, 355-366.
- Meek D.W. and Knippschild U. 2003. Posttranslational modification of MDM2. Mol. Cancer Res. 1, 1017-1026.
- Nihira N.T. et al. 2017. Acetylation-dependent regulation of MDM2 E3 ligase activity dictates its oncogenic function. Sci. Signal. DOI: 10.1126/scisignal.aai8026.
- Wang X. et al. 2004. Inhibition of p53 degradation by Mdm2 acetylation. FEBS Lett. 561, 195-201.
- Linares L. et al. 2007. Intrinsic ubiquitination activity of PCAF controls the stability of the oncoprotein Hdm2. Nat. Cell Biol. 9, 331-338.
- Ranaweera R.S. and Yang X. 2013. Auto-ubiquitination of Mdm2 enhances its substrate ubiquitin ligase activity. J. Biol. Chem. 288, 18939-18946.
- Geiss-Friedlander R. and Melchior F. 2007. Concepts in sumoylation: a decade on. Nat. Rev. Mol. Cell Biol. 8, 947-956.
- Buschmann T. et al. 2001. The Mdm-2 amino terminus is required for Mdm2 binding and SUMO-1 conjugation by the E2 SUMO-1 conjugating enzyme Ubc9. J. Biol. Chem. 276, 40389-40395.
- Miyauchi Y. et al. 2002. Sumoylation of Mdm2 by protein inhibitor of activated STAT (PIAS) and RanBP2 enzymes. J. Biol. Chem. 277, 50131-50136.
- Hay T.J. and Meek D.W. 2000. Multiple sites of in vivo phosphorylation in the MDM2 oncoprotein cluster within two important functional domains. FEBS Lett. 478, 183-186.
- Mayo L.D. and Donner D.B. 2001. A phosphatidylinositol 3-kinase/Akt pathway promotes translocation of Mdm2 from the cytoplasm to the nucleus. Proc. Natl. Acad. Sci. U.S.A. 98, 11598-11603.
- Mayo L.D. et al. 1997. Mdm-2 phosphorylation by DNA-dependent protein kinase prevents interaction with p53. Cancer Res. 57, 5013-5016.
- Lu X. et al. 2008. The Wip1 phosphatase and Mdm2: cracking the "Wip" on p53 stability. Cell Cycle. 7, 164-168.
- Kawai H. et al. 2001. Dual role of p300 in the regulation of p53 stability. J. Biol. Chem. 276, 45928-45932.
- Michael D. and Oren M. 2003. The p53-Mdm2 module and the ubiquitin system. Semin. Cancer Biol. 13, 49-58.
Signal Seeker™タンパク質濃縮キット
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Signal-SeekerTM Acetyl-Lysine Detection Kit |
CYT | BK163 | 30 ASSAY |
CYT社 BK163L 1 を参照 |
Signal-SeekerTM Acetyl-Lysine Detection Kit |
CYT | BK163-S | 10 ASSAY |
¥128,000 |
Signal-SeekerTM Phosphotyrosine Detection Kit |
CYT | BK160 | 30 ASSAY |
CYT社 BK160L 1 を参照 |
Signal-SeekerTM Phosphotyrosine Detection Kit |
CYT | BK160-S | 10 ASSAY |
¥128,000 |
Signal-SeekerTM Ubiquitin Detection Kit |
CYT | BK161 | 30 ASSAY |
CYT社 BK161L 1 を参照 |
Signal-SeekerTM Ubiquitin Detection Kit |
CYT | BK161-S | 10 ASSAY |
¥128,000 |
Signal-SeekerTM SUMOylation Detection Kit |
CYT | BK162 | 30 ASSAY |
CYT社 BK162L 1 を参照 |
Signal-SeekerTM SUMOylation Detection Kit |
CYT | BK162-S | 10 ASSAY |
¥128,000 |
PTM抗体、ビーズ、その他
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti Acetyl Lysine (Mouse)  |
CYT | AAC02 | 2*100 UL |
CYT社 AAC02L 2*100 を参照 |
Anti Acetyl Lysine (Trial size) (Mouse)  |
CYT | AAC02-S | 1*25 UL |
¥38,000 |
Anti Acetyl Lysine (Mouse)  |
CYT | AAC03 | 2*100 UL |
CYT社 AAC03L 2*100 を参照 |
Anti Acetyl Lysine (Trial size) (Mouse)  |
CYT | AAC03-S | 1*25 UL |
¥38,000 |
Anti Acetyl Lysine (Mouse) Horseradish Peroxidase |
CYT | AAC03-HRP | 1*100 UL |
¥150,000 |
Anti Acetyl Lysine (Trial size) (Mouse) Horseradish Peroxidase |
CYT | AAC03-HRP-S | 1*25 UL |
¥52,000 |
Anti Acetyl Lysine Affinity Beads (Mouse)  |
CYT | AAC04-BEADS | 4*500 UL |
CYT社 AAC04BEADSA 4*500 を参照 |
Anti Phosphotyrosine Affinity Beads, (Mouse) , 27B10.4 |
CYT | APY03-BEADS | 4*300 UL |
CYT社 APY03BEADS 4*330 を参照 |
Anti SUMO-2/3 Affinity Beads, (Mouse) , 11G2 |
CYT | ASM24-BEADS | 800 UL [2 x 400 μl] |
CYT社 ASM24BEADSA 2*400 を参照 |
Ubiquitin Affinity Beads |
CYT | UBA01 | 40 RXN [4x420 ul] |
販売終了 |
Control for Ippt IgG beads |
CYT | CIG01-BEADS | 10 ASSAY |
CYT社 CIG01BEADS10 10 を参照 |
| Control for Ubiquitin Affinity Beads | CYT | CUB01 | 10 ASSAY |
販売終了 |
【商品情報】
- アセチルリジン マウスモノクローナル抗体[CYT]
- 翻訳後修飾されたアセチル化リジンを幅広く検出 - SUMO-2/3 アフィニティービーズ[CYT]
- 免疫沈降(IP)によるSUMO化タンパク質の濃縮に最適
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













