記事ID : 36104
Rac1B、がん、およびRac1 CYTOSKELETON NEWS 2019年8月号

Rac1B、がん、およびRac1
Rac1B GTPaseは、Rac1の選択的スプライスバリアントであり、いずれもGTPaseのRasスーパーファミリーにおけるRhoサブファミリーです。Rac1Bに19アミノ酸が(エキソン3bとして知られる)挿入されることで、GDPへの親和性が低減するとともにRac1に比べて内因性GTP加水分解が低減し、より迅速なGEF非依存性GDP/GTPヌクレオチド交換が与えられます1-3)(図1)。Rac1Bは、生化学的には恒常活性型のRac1 GTPaseと同様に振る舞うものの、発がん性RhoサブファミリーGTPase変異体とは異なったメカニズムを介します4)。Rac1Bは、細胞周期進行の制御やアポトーシス耐性増大を始めとする発がんの数々の局面に関与します。さらに、GTPaseは悪性形質転換、上皮間葉転換(EMT)、転移、および浸潤を含む腫瘍進行において複数の役割をもちます3)。本ニュースレターでは、腫瘍発生におけるRac1Bの役割やRac1との関係に関するいくつかの近年の発見についてお伝えします。
NIH3T3マウス線維芽細胞においてRac1Bが細胞形質転換を促進することやRac1Bを過剰発現するがん(例えば、結腸がん、ヒト肺腺がん、甲状腺がん)において腫瘍増殖を促進する可能性がいくつかの研究でわかっていることから、Rac1Bは腫瘍化促進性GTPaseとして広範に注目されています3, 5)。腫瘍発生におけるRac1Bの役割として、慢性炎症を生じる情報伝達経路の活性化、増殖促進遺伝子の転写、増殖阻害と細胞周期停止を刺激するシグナル伝達経路の阻害、および細胞接着を低減し細胞遊走を促進するシグナル伝達経路の調節があります3)(図2)。Rac1Bはまた、乳がん、肺がん、および膵臓がんにおけるマトリックスメタロプロテアーゼ3(MMP3)誘導性EMTにおいても重要な役割を担います3, 6-8)。逆に、Rac1Bは特定のがん(例えば、膵管腺がん[PDAC])において抗腫瘍効果を発揮することもできます。PDAC由来細胞においてRac1BはTGF-Β1に誘導されたEMTを阻害することが、細胞形態の変化測定、EMTマーカーの遺伝子発現、TGF-Β1活性化のシグナル伝達カスケード、細胞遊走、およびRac1Bのエキソン3bを標的としたRNAi誘導性ノックダウンによる増殖阻害より特定されています3, 9, 10)。さらに、Rac1Bにおいて様々なGTPase阻害剤物質がRac1よりも選択的であることから治療標的としての可能性があります11)。また、いくつかのがんにおいてRac1Bは予後マーカーとして機能する可能性があります(例えば、乳がん、結腸がん、肝細胞がん、非小細胞肺がん、膵がん、慢性膵炎、および甲状腺がん)12-14)。
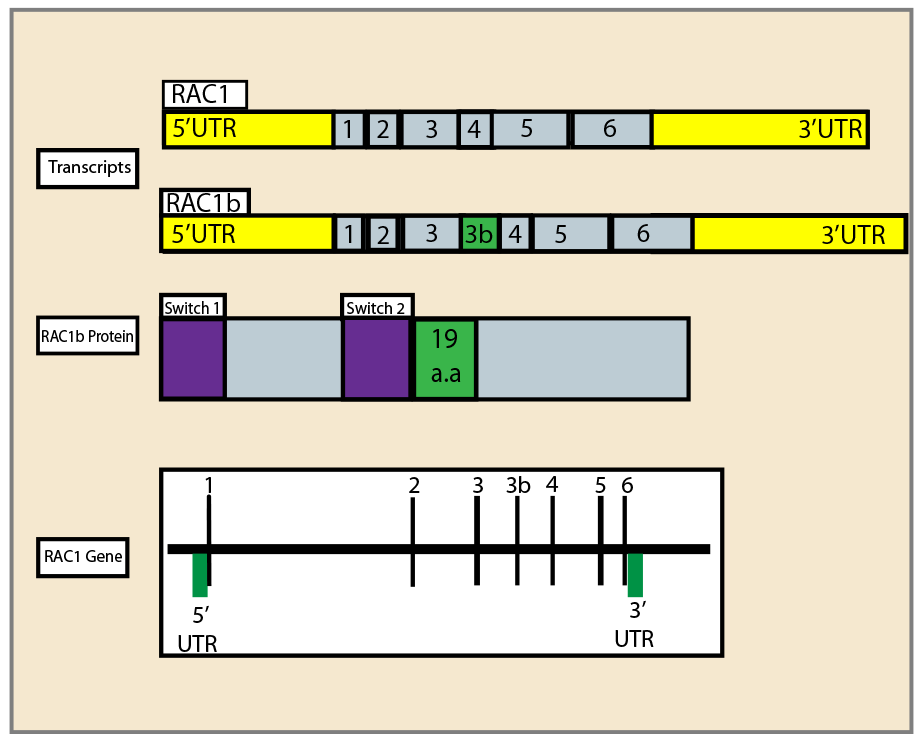
図1.RAC1遺伝子、選択的転写物、およびRAC1bタンパク質の図
1, 2, 3, 4, 5, 6はエキソンを示す。a.a:アミノ酸
上流の活性化因子、下流の標的、および結合パートナー
Rac1Bは、がんに関係する複数のシグナル伝達カスケードにおいて複合的な制御を担っています(図2)。例えば、Rac1Bが負に制御する分裂促進因子活性化タンパク質キナーゼのメンバーを含め、Rac1Bは複数のキナーゼ活性を制御します3)。逆に、Rac1Bは、腫瘍発生を促進または阻害する転写因子ファミリーのNFΚB(活性型B細胞の核内因子Κ軽鎖転写促進因子)を活性化し15)、これは結腸がん細胞においてRelB介在性の負のフィードバック経路の活性化を防ぐために行われると考えられています16)。甲状腺がんにおいては、Rac1B過剰発現によりNFΚB介在性増殖促進と抗アポトーシス性シグナル伝達経路が刺激されます17)。Rac1Bに影響されるシグナル伝達経路として、この他にWnt/ΒカテニンやTGF-Βシグナル伝達があります3)。興味深いことに、Rac1BはRho-GDP解離抑制因子(Rho-GDI)とは相互作用せず、これに対し、Rac1は相互作用を行います5, 15)。Rac1Bはp21活性化キナーゼ(PAK)のGTPase結合ドメインにGTP依存性で結合できるものの、全長PAKには結合できません15)。Rac1に比べ、Rac1BはRho-GDI、GIT-1、およびIQGAPといったRhoファミリーエフェクターに結合できないか、またはより低い親和性で結合します。これに対し、Rac1Bは、転写制御、細胞間接着、および運動性に関与するタンパク質(例えば、SmgGDS、RACK1、および p120(ctn))に強力に結合します3, 18)。Rac1BがRho-GDIと相互作用できないということは、ほとんどのRac1BがRho-GDI介在性隔離が存在しない状態において細胞膜に結合することを意味します。したがって、細胞におけるRac1B発現量は低レベルであるものの、Rac1に比べて活性化を行うことが可能な割合はより大きいといえます3, 5, 15)。さらに、Rac1Bは細胞膜においてユビキチン化の影響を受けません(Rac1Bは、Rac1ユビキチン化を媒介するJun-N末端キナーゼを活性化できません)3, 19)。
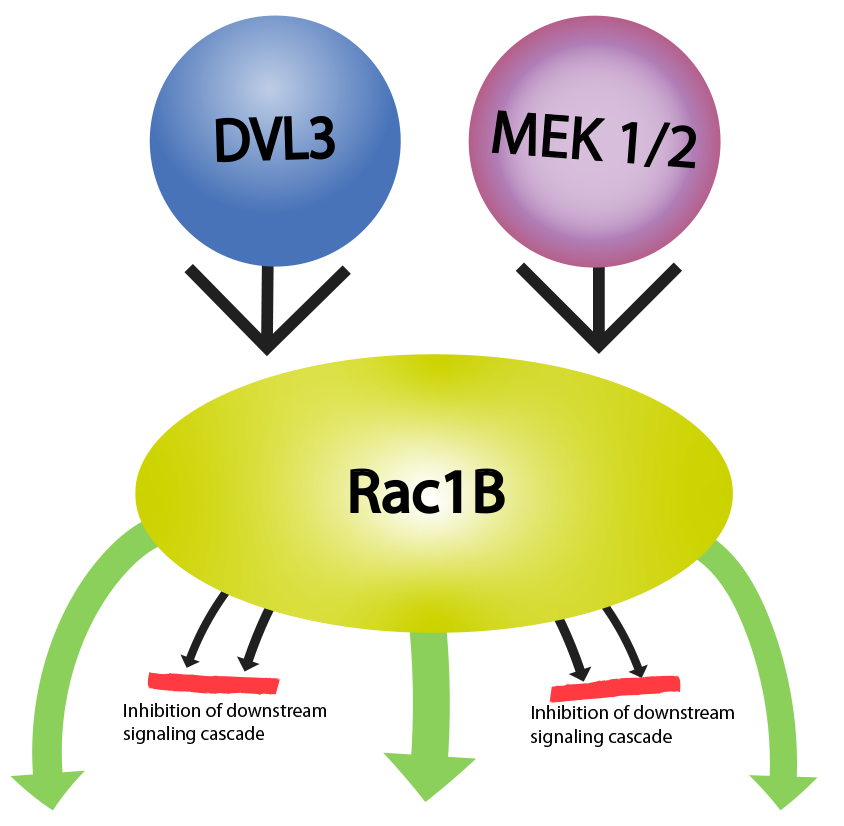
図2.腫瘍発生に関与するRac1B介在性シグナル伝達
Rac1Bより外向きに向かう緑色矢印は下流のシグナル伝達カスケードの活性化を示し、Rac1Bに向かう矢印は情報伝達経路の活性化(DVL3)またはタンパク質発現増大(MEK1/2)の何れかを示す。赤線は下流のシグナル伝達カスケード阻害を示す。
Rac1B は Rac1を阻害
Rac1Bは、Rac1活性を負に調節します20, 21)。HeLa細胞では、Rac1B発現がPDGF-誘導性Rac1活性化を妨害し、膜結合Rac1の比率を低減させ、Rho活性を上昇させます。予想されるように、これらの細胞機能の基礎をなしているRhoやRac GTPaseに制御されるアクチン細胞骨格動態が変化することで、この変化は細胞形態や運動性の変化として現れます20)。同様に、膵がん細胞株においてsiRNAによりRac1Bをノックダウンすると、Rac1タンパク質レベルの増大と相関性がみられます10)。Rac1とRac1BはTGF-Β1誘導性細胞遊走を個別に調節し、前者はTGF-Β1介在性細胞遊走を促進するのに対し、Rac1Bはそれを阻害します9, 21)。
まとめ
Rac1Bの腫瘍発生における独特な役割が理解されつつあることは明らかであるものの、まだ発見されていないことが数多くあり、Rac1Bの予後指標や治療標的としての全潜在能力はまだよくわかっていません。がん関連シグナル伝達カスケードにおいてRac1BとRac1とをさらに区別することも、最も重要なことのひとつでしょう。この分野におけるRac1Bの可能性を解明することに焦点を当てた研究の中には、血清中におけるRac1/Rac1B比率をリアルタイムで測定するバイオセンサーを利用したシステムの開発22)や、Rac1B過剰発現により描写されるこれらのがんにおいてRac1/Rac1B比率転換を行う治療の実現可能性研究 3)があります。Cytoskeleton社では、これらの研究をサポートするため、RhoファミリーGTPase活性アッセイキット、抗体、GEFやGAP活性アッセイキット、F-アクチン用の生細胞画像処理プローブ、およびRac1Bの上流または下流に位置する標的タンパク質の翻訳後修飾研究用Signal Seeker kitsをはじめとした広範なGTPase試薬を提供しています。参考文献
- Schnelzer A. et al. 2000. Rac1 in human breast cancer: Overexpression, mutation analysis, and characterization of a new isoform, rac1b. Oncogene. 19, 3013-3020.
- Fiegen D. 2004. Alternative splicing of rac1 generates rac1b, a self-activating gtpase. J. Biol. Chem. 279, 4743-4749.
- Melzer C. et al. 2019. RAC1B: A Rho GTPase with versatile functions in malignant transformation and tumor progression. Cell. 8, 21.
- Haeusler L.C. et al. 2006. Purification and biochemical properties of rac1, 2, 3 and the splice variant rac1b. Methods Enzymol. 406, 1-11.
- Singh A. et al. 2004. Rac1b, a tumor associated constitutively active rac1 splice variant, promotes cellular transformation. Oncogene. 23, 9369-9380.
- Lee K. et al. 2012. Matrix compliance regulates rac1b localization, nadph oxidase assembly, and epithelial-mesenchymal transition. Mol. Biol. Cell. 23, 4097-4108.
- HChen Q.K. et al. 2013. Extracellular matrix proteins regulate epithelial-mesenchymal transition in mammary epithelial cells. Differentiation. 86, 126-132.
- Mehner C. et al. 2014. Tumor cell-derived mmp3 orchestrates rac1b and tissue alterations that promote pancreatic adenocarcinoma. Mol. Cancer Res. 12, 1430-1439.
- Ungefroren H. et al. 2014. Rac1b negatively regulates TGF-Β1-induced cell motility in pancreatic ductal epithelial cells by suppressing Smad signalling. Oncotarget. 5, 277-290.
- Witte D. et al. 2017. Negative regulation of TGF-Β1-induced MKK6-p38 and MEK-ERK signalling and epithelial-mesenchymal transition by Rac1b. Sci. Rep. 7, 17313.
- Beausoleil E. et al. 2009. Structure-activity relationship of isoform selective inhibitors of rac1/1b gtpaseucleotide binding. Bioorg. Med. Chem. Lett. 19, 5594-5598.
- Alonso-Espinaco V. et al. 2014. Rac1b overexpression correlates with poor prognosis in kras/braf wt metastatic colorectal cancer patients treated with first-line folfox/xelox chemotherapy. Eur. J. Cancer. 50, 1973-1981.
- Mehner C. et al. 2015. Tumor cell expression of MMP3 as a prognostic factor for poor survival in pancreatic, pulmonary, and mammary carcinoma. Genes Cancer. 6, 480-489.
- Guinney J. et al. 2015. The consensus molecular subtypes of colorectal cancer. Nat. Med. 21, 1350-1356.
- Matos P. et al. 2003. Tumor-related alternatively spliced rac1b is not regulated by rho-gdp dissociation inhibitors and exhibits selective downstream signaling. J. Biol. Chem. 278, 50442-50448.
- Matos P. and Jordan P. 2006. Rac1, but not rac1b, stimulates relb-mediated gene transcription in colorectal cancer cells. J. Biol. Chem. 281, 13724-13732.
- Faria M. et al. 2017 Rac1b overexpression stimulates proliferation and nf-kb-mediated anti-apoptotic signaling in thyroid cancer cells. PLoS ONE. 12, e0172689.
- Orlichenko L. et al. 2010. The 19-amino acid insertion in the tumor-associated splice isoform rac1b confers specific binding to p120 catenin. J. Biol. Chem. 285, 19153-19161.
- Visvikis O. et al. 2008. Activated rac1, but not the tumorigenic variant rac1b, is ubiquitinated on Lys 147 through a jnk-regulated process. FEBS J. 275, 386-396.
- Nimnual A.S. et al. 2010. Perturbation of cytoskeleton dynamics by the opposing effects of rac1 and rac1b. Small GTPases. 1, 89-97.
- Melzer C. et al. 2017. The role of TGF-Β and its crosstalk with RAC1/RAC1b signaling in breast and pancreas carcinoma. Cell Commun. Signal. 15, 19.
- Sahu V. et al. 2016. Quantification of Rac1 and Rac1b in serum of non small cell lung cancer by label free real time assay. Clin. Chim. Acta. 460, 231-235
G-LISA Kits
[商品詳細]
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
RhoA G-LISA(R) Activation Assay (luminescence) |
CYT | BK121 | 96 ASSAY |
¥302,000 |
RhoA G-LISA(R) Activation Assay (absorbance) |
CYT | BK124 | 96 ASSAY |
¥302,000 |
RhoA G-LISA(R) Activation Assay (absorbance), Trial Size |
CYT | BK124-S | 24 ASSAY |
¥189,000 |
Rac1,2,3 G-LISA(R) Activation Assay Kit |
CYT | BK125 | 96 ASSAY |
¥302,000 |
Rac1 G-LISA(R) Activation Assay Kit |
CYT | BK126 | 1 KIT [96 assays] |
¥302,000 |
Cdc42 G-LISA(R) Activation Assay Kit |
CYT | BK127 | 96 ASSAY |
¥302,000 |
Cdc42 G-LISA(R) Activation Assay Kit, Trial Size |
CYT | BK127-S | 24 ASSAY |
¥189,000 |
Rac1 G-LISA(R) Activation Assay Kit |
CYT | BK128 | 1 KIT [96 assays] |
¥302,000 |
Rac1 G-LISA(R) Activation Assay Kit, Trial Size |
CYT | BK128-S | 24 ASSAY |
¥189,000 |
RalA G-LISA(R) Activation Assay Kit |
CYT | BK129 | 1 KIT [96 assays] |
¥302,000 |
Ras G-LISA(R) Activation Assay Kit |
CYT | BK131 | 1 KIT [96 assays] |
¥302,000 |
Arf1 G-LISA Activation Assay Kit |
CYT | BK132 | 96 ASSAY |
販売終了 |
Arf6 G-LISA Activation Assay Kit |
CYT | BK133 | 96 ASSAY |
販売終了 |
G-LISA Bundle (BK135 = BK124-S + BK127-S + BK128-S) |
CYT | BK135 | 3 KIT [24 assays/kit] |
お問い合わせ |
RhoA ELISA Kit |
CYT | BK150 | 1 KIT [96 assays] |
¥169,000 |
Rho Family Small G-Protein Tools
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Rho Activator |
CYT | CN01-A | 5*10 UNIT |
¥71,000 |
Rho Activator |
CYT | CN01-B | 20*10 UNIT |
¥254,000 |
Rac and Cdc42 Activator, Mouse |
CYT | CN02-A | 5*10 UNIT |
¥71,000 |
Rac and Cdc42 Activator |
CYT | CN02-B | 20*10 UNIT |
¥254,000 |
Rho Activator II |
CYT | CN03-A | 3*20 UG |
¥71,000 |
Rho Activator II |
CYT | CN03-B | 9*20 UG |
¥200,000 |
Rho/Rac/Cdc42 Activator I |
CYT | CN04-A | 3*20 UG |
¥71,000 |
Rho/Rac/Cdc42 Activator I |
CYT | CN04-B | 9*20 UG |
¥200,000 |
Cell Permeable Rho Inhibitor (C3 Trans based), Clostridium botulinum , Unlabeled |
CYT | CT04-A | 1*20 UG |
¥68,000 |
Cell Permeable Rho Inhibitor (C3 Trans based), Clostridium botulinum , Unlabeled |
CYT | CT04-B | 5*20 UG |
¥224,000 |
Pull-Down Activation
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Ras Activation Assay Biochem Kit |
CYT | BK008 | 1 KIT [50 assays] |
¥269,000 |
Ras Activation Assay Biochem Kit |
CYT | BK008-S | 1 KIT [20 assays] |
¥124,000 |
Combo RhoA/Rac1/Cdc42 Activation Assay Kit |
CYT | BK030 | 1 KIT [3 x 10 assays] |
¥327,000 |
Arf1 Pulldown Activation Assay Kit |
CYT | BK032-S | 20 ASSAY |
¥160,000 |
Arf6 Pulldown Activation Assay Kit |
CYT | BK033-S | 20 ASSAY |
¥160,000 |
Cdc42 Pulldown Activation Assay Kit |
CYT | BK034 | 1 KIT [50 assays] |
¥269,000 |
Cdc42 Pulldown Activation Assay Kit |
CYT | BK034-S | 1 KIT [20 assays] |
¥124,000 |
Rac1 Pulldown Activation Assay Kit |
CYT | BK035 | 1 KIT [50 assays] |
¥269,000 |
Rac1 Pulldown Activation Assay Kit |
CYT | BK035-S | 1 KIT [20 assays] |
¥124,000 |
RhoA Pulldown Activation Assay Kit |
CYT | BK036 | 1 KIT [80 assays] |
¥269,000 |
RhoA Pulldown Activation Assay Kit |
CYT | BK036-S | 1 KIT [20 assays] |
¥124,000 |
RalA Activation Assay Biochem Kit |
CYT | BK040 | 50 ASSAY |
販売終了 |
PAK-PBD, agarose bead, Human |
CYT | PAK02-A | 1*500 UG |
CYT社 PAK02A 2*500 を参照 |
PAK-PBD, agarose bead, Human |
CYT | PAK02-B | 4*500 UG |
CYT社 PAK02B 6*500 を参照 |
Rhotekin-RBD on agarose beads |
CYT | RT02-A | 2*2 MG |
¥218,000 |
Rhotekin-RBD on agarose beads |
CYT | RT02-B | 6*2 MG |
お問い合わせ |
Acti-Stain Phalloidins
[商品詳細]
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Acti-stainTM 488 phalloidin, Plant |
CYT | PHDG1-A | 1*500 UL [300 slides] |
¥74,000 |
Acti-stainTM 555 phalloidin, Mushroom |
CYT | PHDH1-A | 1*500 UL [300 slides] |
¥74,000 |
Acti-stainTM 670 phalloidin, Plant |
CYT | PHDN1-A | 1*500 UL [300 slides] |
¥74,000 |
Phalloidin; Fluorescent Derivatives (Acti-StainTM 535), Rhodamine Isothiocyanate |
CYT | PHDR1 | 1*500 UL [300 slides] |
¥74,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













