記事ID : 10914
蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬 CYTOSKELETON NEWS 2013年3月号

蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
全世界で500万人の患者が苦しんでいる特発性肺線維症(IPF;Idiopathic Pulmonary Fibrosis)は、生存期間中央値が3〜5年程度と言われています1,2,3。この線維性の疾患は、慢性炎症性の組織修復反応であると考えられており、結合組織の過剰な堆積という特徴が、器官の構造と機能の不全を引き起こします4。フィブロネクチン(FN)の原線維形成は、細胞が媒介するプロセスで、溶解性の血漿FNを不溶性のFNに変換します。この過程が、IPFの進行の中心的な役割を担っています5。FNは、2つのC末端がジスルフィド結合でつながった二量体の糖タンパク質として分泌されます。70kDaのN末端ドメイン、120kDaの中央結合ドメイン、ヘパリン結合ドメインHepIIなどの、複数の機能ドメインから構成されています4。これらのドメインは、段階的に細胞表面レセプターと相互作用しますが、その最初の段階として、インテグリンとHSPG(heparin sulfate proteoglycan:ヘパリン硫酸プロテオグリカン)という細胞表面レセプターと結合します(図1)4。この結合が、細胞の緊張を生み出すアクチン細胞骨格の再編成を引き起こします。また、FNが結合したレセプターのクラスター形成や移動により、FNダイマーがアンフォールドして拡張構造になることで、FN同士の相互作用のための結合部位が露出します4。原線維形成は、制御不能の線維症につながり、IPFのような悪性の管理不能な組織の成長を引き起こすこともあります4,6が、不溶性の細胞FNは、細胞接着、成長、移動、分化において重要な役割を果たしており、創傷治癒、結合組織の堆積4,7、胚の発生7など、回復や発生にとって必要なことでもあります。
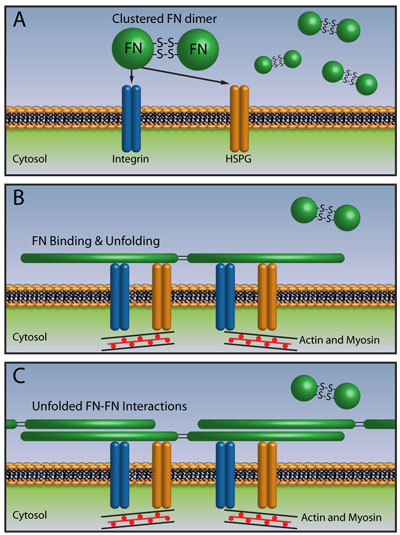
図1 フィブロネクチンマトリックスの凝集(参考文献4参照)
(A)未結合のコンパクトFNダイマーと細胞膜レセプター
(B)FNの結合が、細胞骨格の再編成を誘導し、細胞の緊張を生み出します。その結果、受容体がクラスターを形成し、アンフォールドしたFNのFN結合部位が露出します
(C)FN結合部位の露出により、FN同士の相互作用が可能になります
IPFのための治療法や直接的な処置方法がない一方で、患者のQOL維持のため、非特異的な治療オプションとして、抗炎症薬ピルフェニドン、免疫抑制剤、副腎皮質ステロイド、アザチオプリン、酸化防止剤N-アセチルシステイン、補助的な酸素治療、肺リハビリテーション、手術などがあります3。加えて、最近、抗炎症薬のサリドマイドとマクロライドがIPFの治療薬として可能性があることが提案されています8,9。実際に、マクロライド系抗生物質による臨床試験において、嚢胞性線維症患者に対して長期間にわたる有用性が確認されました9。より直接的な治療法として、抗TGF-β化合物とFUDペプチドが期待されています4。マウスを抗TGF-β処理することにより、sclerodermatousGVHD(移植片対宿主病)における皮膚線維症、肺線維症を減少させました4。しかしながら、ヒトの系の硬化症に対する抗TGF処置の臨床試験PhaseI/IIは成功していません。F1アドヘシンタンパク質のFUDドメインの残基配列は、FNのN末端のFNIドメインに結合することにより、FNマトリクスの凝集を阻害します1-5。このドメインがFNが細胞レセプターに結合するのに重要であり4、FN結合ドメインが、線維症疾患の治療のための薬剤ターゲットとなりうることを証明しています。
FNマトリックスの凝集を調節するメカニズムがわかってくるにつれて、線維性疾患に対するより良い治療法を発見できる可能性も高まります。特定のモジュレーターによるin vivoでのFNの効果の増強又は抑制は、線維症の研究で特に興味を持たれています6。最近のハイスループットスクリーニング(HTS)メソッドの進歩により、FNの原線維形成に対するそれらの効果についての小分子ライブラリーのスクリーニングが容易になっています6。Tomasini-Hohanssonら6による分析では、FN原線維形成の読み取りを行うために蛍光標識FNを利用しています(Z値>0.5)。Tomasini-Hohanssonらのパイロット試験により4160種類の既知の生理活性化合物がスクリーニングされました。この研究により9つの化合物がFNの凝集を阻害することがわかりました。この9つの化合物は、4つのキナーゼ阻害剤(ML-9、HA-100、チロホスチン、メシル酸イマチニブ)、2つの癌細胞アポトーシス促進剤(piperlongumin、カンタリジン)、3つの生体アミンシグナリングのモジュレーター(マプロチリン、CGS12066B、アポスコポラミン)です。
HTS技術に蛍光標識FNを用いることで、FN原線維形成のさらなるモジュレーターが、線維症疾患の治療法の開発に役立つ可能性があります。サイトスケルトン社では、FN原線維形成を研究するためのローダミン、HiLyte488™、ビオチン標識したECMをご提供致します。
参考文献
1. Buck and Chojkier, 2011. C/EBPβ-Thr217 phosphorylation signaling contributes to the development of lung injury and fibrosis in mice. PloS One. 6: e25497.
2. Raghu et al., 2006. Incidence and prevalence of idiopathic pulmonary fibrosis. Am. J. Respir. Crit. Care Med. 174, 810-816.
3. http://www.pulmonaryfibrosis.org/Prevalence
4. To and Midwood, 2011. Plasma and cellular fibronectin: distinct and independent functions during tissue repair. Fibrogenesis & Tissue Repair. 4: 21.
5. Pankov and Momchilova, 2009. Fluorescent labeling techniques for investigation of fibronectin fibrillogenesis (labeling fibronectin fibrillogenesis). Methods Mol. Biol. 522, 261-274.
6. Tomasini-Johansson et al., 2012. Quantitative microtiter fibronectin fibrillogenesis assay: Use in high throughput screening for identification of inhibitor compounds. Matrix Biol. 31, 360-367.
7. Pankov and Yamada, 2002. Fibronectin at a glance. J. Cell Sci. 115, 3861-3863.
8. Horton and Hallowell, 2012. Revisiting thalidomide: fighting with caution against idiopathic pulmonary fibrosis. Drugs Today (Barc.). 48, 661-671.
9. Cameron et al., 2012. Long‐term macrolide treatment of chronic inflammatory airway diseases: risks, benefits and future developments. Clin. Exp. Allergy. 42, 1302-1312.
ECMタンパク質
蛍光標識またはビオチン標識したフィブロネクチンとラミニン
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Fibronectin, Bovine, HiLyte FluorTM 488 |
CYT | FNR02-A | 5*20 UG |
¥124,000 |
Fibronectin, Bovine, HiLyte FluorTM 488 |
CYT | FNR02-B | 20*20 UG |
¥339,000 |
Fibronectin, Bovine |
CYT | FNR03-A | 5*20 UG |
¥124,000 |
Fibronectin, Bovine |
CYT | FNR03-B | 20*20 UG |
¥339,000 |
Laminin, Mouse |
CYT | LMN01-A | 5*20 UG |
¥136,000 |
Laminin, Mouse |
CYT | LMN01-B | 20*20 UG |
¥363,000 |
Laminin, Mouse, HiLyte FluorTM 488 |
CYT | LMN02-A | 5*20 UG |
¥136,000 |
Laminin, Mouse, HiLyte FluorTM 488 |
CYT | LMN02-B | 20*20 UG |
¥363,000 |
Laminin, Mouse, Biotin |
CYT | LMN03-A | 5*20 UG |
¥136,000 |
Laminin, Mouse, Biotin |
CYT | LMN03-B | 20*20 UG |
¥363,000 |
低分子量Gタンパク質活性アッセイ
サイトスケルトン社のG-LISAでは低分子Gタンパク質活性化アッセイを迅速かつ高感度に行えます
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Combo RhoA/Rac1/Cdc42 Activation Assay Kit |
CYT | BK030 | 1 KIT [3 x 10 assays] |
¥327,000 |
Arf1 G-LISA Activation Assay Kit |
CYT | BK132 | 96 ASSAY |
販売終了 |
Arf1 Pulldown Activation Assay Kit |
CYT | BK032-S | 20 ASSAY |
¥160,000 |
Arf6 G-LISA Activation Assay Kit |
CYT | BK133 | 96 ASSAY |
販売終了 |
Arf6 Pulldown Activation Assay Kit |
CYT | BK033-S | 20 ASSAY |
¥160,000 |
Cdc42 G-LISA(R) Activation Assay Kit |
CYT | BK127 | 96 ASSAY |
¥302,000 |
Cdc42 Pulldown Activation Assay Kit |
CYT | BK034-S | 1 KIT [20 assays] |
¥124,000 |
Cdc42 Pulldown Activation Assay Kit |
CYT | BK034 | 1 KIT [50 assays] |
¥269,000 |
Rac1,2,3 G-LISA(R) Activation Assay Kit |
CYT | BK125 | 96 ASSAY |
¥302,000 |
Rac1 G-LISA(R) Activation Assay Kit |
CYT | BK128 | 1 KIT [96 assays] |
¥302,000 |
Rac1 G-LISA(R) Activation Assay Kit |
CYT | BK126 | 1 KIT [96 assays] |
¥302,000 |
Rac1 Pulldown Activation Assay Kit |
CYT | BK035-S | 1 KIT [20 assays] |
¥124,000 |
Rac1 Pulldown Activation Assay Kit |
CYT | BK035 | 1 KIT [50 assays] |
¥269,000 |
RalA G-LISA(R) Activation Assay Kit |
CYT | BK129 | 1 KIT [96 assays] |
¥302,000 |
RalA Activation Assay Biochem Kit |
CYT | BK040 | 50 ASSAY |
販売終了 |
Ras G-LISA(R) Activation Assay Kit |
CYT | BK131 | 1 KIT [96 assays] |
¥302,000 |
Ras Activation Assay Biochem Kit |
CYT | BK008-S | 1 KIT [20 assays] |
¥124,000 |
Ras Activation Assay Biochem Kit |
CYT | BK008 | 1 KIT [50 assays] |
¥269,000 |
RhoA G-LISA(R) Activation Assay (absorbance) |
CYT | BK124 | 96 ASSAY |
¥302,000 |
RhoA G-LISA(R) Activation Assay (luminescence) |
CYT | BK121 | 96 ASSAY |
¥302,000 |
RhoA Pulldown Activation Assay Kit |
CYT | BK036-S | 1 KIT [20 assays] |
¥124,000 |
RhoA Pulldown Activation Assay Kit |
CYT | BK036 | 1 KIT [80 assays] |
¥269,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













