記事ID : 16713
Rac1と糖尿病: ポジティブな役割とネガティブな役割 CYTOSKELETON NEWS 2016年4月号

Rac1と糖尿病: ポジティブな役割とネガティブな役割
はじめに
血糖値の上昇が膵臓β細胞で感知されると、ミトコンドリアでの糖代謝を含む、複雑なシグナル伝達経路を介した応答がおこります1。この経路では、最終的に細胞内のインスリンを含む小胞が細胞膜に融合し、インスリンが血中に放出されます(グルコース刺激インスリン分泌(GSIS: glucose-stimulated insulin secretion)と呼ばれます1)。その後、骨格筋、脂肪組織、肝臓などのインスリン標的組織によって、血糖の正常化が促進されます。インスリンは、標的組織の細胞上でインスリン受容体に結合すると、グルコース輸送体である GLUT4 を移行させるシグナルを伝達し、GLUT4 が活発に細胞膜との間を往復することで、血液からの糖(グルコース)取り込みが可能になります2。
慢性的な高血糖(高血糖症)は、脂質毒性(脂質異常症)を伴う糖毒性の状態を引き起こし、2型糖尿病(T2D: Type 2 Diabetes)の発症につながります。糖尿病の発症率は上昇し続けており、世界の糖尿病人口は2015年の時点で推定 4億1500万人に上ります3。2型糖尿病において持続的高血糖を引き起こす要因となるのは、一般的には標的組織におけるインスリン抵抗性と、グルコース刺激インスリン分泌(GSIS)の撹乱です4。2型糖尿病患者が、血糖値を制御するために、食事療法に加えて運動を推奨されることは注目に値します。運動療法は、骨格筋の収縮によって、インスリン非依存性の機構を介した糖取り込みが起こることを利用しています5。
Rac1 のポジティブな役割 - 糖(グルコース)制御の促進
Rho ファミリー低分子量 GTPase である Rac1 は、膵臓β細胞でのグルコース刺激インスリン分泌(GSIS)と、骨格筋での GLUT4 の細胞膜移行の両方のプロセスで、重要な役割を担っています。この2つのプロセスにおける Rac1 の役割は、皮質アクチン構造の変化を介した小胞輸送の促進であると考えられます6-7。マウスの遺伝子ノックアウト、または、siRNA による Rac1 の抑制のいずれかにより、 Rac1 の機能を低下させると、グルコース刺激インスリン分泌(GSIS)が抑制されます6,8。また、Rac1 と、その上流の活性化因子であるグアニンヌクレオチド交換因子(GEF)との結合を阻害することにより、直接/間接的に Rac1 の活性化を阻害する小分子を用いて、Rac1 のグルコース刺激インスリン分泌(GSIS)における重要性が薬理学的に確認されています。間接的な阻害剤である NSC23766 および EHop-016 は、Rac1 と グアニンヌクレオチド交換因子(GEF)である Tiam1 および Vav2 との相互作用を、それぞれ阻害します9-10。
これらの阻害剤を、INS 832/13 細胞 および 初代ラット膵島細胞に用いたところ、グルコースにより誘導される Rac1の活性化と膜結合が抑制され、グルコース刺激インスリン分泌(GSIS)が減少しました11-12。また、INS 832/13 細胞の Tiam1 または Vav2 siRNA ノックダウンも、グルコースにより誘導される Rac1 の活性化を阻害することから11-12、グルコースに応答して活性化された Rac1 に対するこれらのGEFの役割が確認されました。さらに、INS 832/13 細胞において、Rac1 の直接的な阻害剤である EHT 186413 も、グルコースにより誘導される Rac1 の活性化を阻害し、グルコース刺激インスリン分泌(GSIS)を抑制します14。本稿では Rac1 に注目していますが、その他の低分子量Gタンパク質(例: Cdc42、Arf6)も、グルコース刺激インスリン分泌(GSIS)に関与することを補足しておきます15。
上述のように、血液中に循環するインスリンに応答して、標的組織で GLUT4 受容体の移行が起こります。Rac1 が GLUT4 の移行に関与しないと考えられる脂肪組織を除いて、このプロセスには、Rac1 とその下流のエフェクターキナーゼである PAK1 が必要となります16。また、Rac1 が、筋収縮による糖取り込みに関与しているのも興味深いことです17。マウスとヒトの骨格筋において、Rac1 と PAK1 の両方が、インスリンに応答して活性化されることが示されています18。Rac1 を筋特異的にノックアウトしたマウスでは、インスリン依存性の PAK1 活性化、GLUT4 の移行、インスリン刺激による骨格筋の糖取り込みが減少します7。また、これらのマウスでは、インスリン応答が全体的に低下することから、骨格筋が糖(グルコース)制御に重要な役割を担っていることが示されます。これらの知見と一致して、低分子量 Rac1 阻害剤 II を薬理学的に使用すると、マウス骨格筋の糖取り込みが低下することが示されています19。
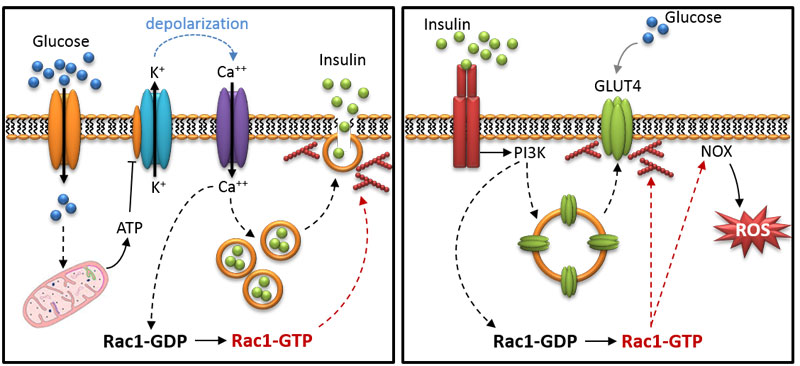
図1
(左)グルコース刺激インスリン分泌(GSIS)の模式図。Rac1 の役割を赤で示す。
(右)標的組織におけるインスリンシグナル伝達。Rac1のポジティブ/ネガティブな役割を赤で示す。
Rac1 のネガティブな役割 - 糖尿病合併症の促進
活性型 Rac1(GTP結合型)は、NADPH オキシダーゼ(Nox)ホロ酵素に必須の構成成分で、ミトコンドリアでの余分な活性酸素種(ROS)の生成に重要な役割を果たしています20。グルコースは、Nox 依存性の ROS 生成を刺激し、ROS の持続的な増加は、グルコース刺激インスリン分泌(GSIS)が適切に起こるために重要であることがわかっています21。しかし、慢性的な高血糖/脂質異常症は、部分的に Rac1/Nox2 を介した ROS の過剰産生につながり、β細胞の機能不全が進展した結果として、グルコース刺激インスリン分泌(GSIS)が低下します22。
管理の不十分な2型糖尿病の長期的な合併症には様々なものがあり、糖尿病性網膜症、神経障害、腎症、心筋症などが含まれます23。また、Rac1は、Rac1 による ROS の過剰産生を介して、上記の病態の(全てではありませんが)大部分に関与していることが数多く報告されています。Rac1 の関与する例を挙げると、糖尿病性心筋症では、Rac1 による ROS 産生が心筋細胞のアポトーシスにつながります24。糖尿病性網膜症では、Rac1 が、疾患の進行に不可欠なステップである血液網膜関門の崩壊を促進することが示されています25。また、Rac1/PAK1 シグナル経路は、糖尿病性腎症に関連する線維症の発症に不可欠な、腎臓での上皮間葉転換(EMT: endothelial-to-mesenchymal transition) として知られるプロセスを促進し、ポドサイト(足細胞)障害に重要であることが示されています26。
まとめ
Rac1 が、2型糖尿病に生理学的かつ病理学的に重要な役割を果たすことが報告されています。このことは、Rac1 を直接標的とした糖尿病の治療には、課題が存在する可能性があることを意味します。対照的に、Rac1 を直接標的として開発された腫瘍薬にとっては、薬剤が癌細胞の糖取り込みを変化させることが利点となる可能性があります。Cytoskeleton社では、生細胞と固定細胞の両方で、Rac1(およびその他の低分子量Gタンパク質)とアクチン細胞骨格のダイナミクスの研究にご使用いただける、試薬・キットを販売しております。
参考文献
- Meda P and Schuit F 2013. Glucose-stimulated insulin secretion: the hierarchy of its multiple cellular and subcellular mechanisms. Diabetologia 56, 2552-2555.
- Foley K, et al. 2011. Endocytosis, recycling, and regulation of exocytosis of glucose transporter 4. Biochemistry 50, 3048-3061.
- IDF 2015 Diabetes Atlas. http://www.diabetesatlas.org/resources/2015-atlas.html
- Unger RH and Grundy S 1985. Hyperglycemia as an inducer as well as a consequence of impaired islet cell function and insulin resistance: implications for the management of diabetes. Diabetologia 28, 118-121.
- Goldstein MS, et al. 1953. Action of muscular work on the transfer of sugars across cell barriers; comparison with the actions of insulin. Am J Physiol 173, 212-216.
- Asahara A, et al. 2008. Rac1 regulates glucose induced insulin secretion through modulation of cytoskeletal organization in beta cells. Diabetes 57(supplement), A55.
- Ueda S, et al. 2010. Crucial role of the small GTPase Rac1 in insulin-stimulated translocation of glucose transporter 4 to the mouse skeletal muscle sarcolemma. FASEB J. 24, 2254-2261.
- Kowluru A 2011. Friendly, and not so friendly, roles of Rac1 in islet ß-cell function: lessons learnt from pharmacological and molecular biological approaches. Biochem Pharmacol 81, 965-975.
- Gao Y, et al. 2004. Rational design and characterization of a Rac GTPase-specific small molecule inhibitor. Proc Natl Acad Sci USA 101, 7618-7623.
- Montalvo-Ortiz BL, et al. 2012. Characterization of EHop-016, a novel small molecule inhibitor of Rac GTPase. J Biol Chem 287, 13228-13238.
- Veluthakal R, et al. 2009. Regulatory roles for Tiam1, a guanine nucleotide exchange factor for Rac1, in glucose-stimulated insulin secretion in pancreatic ß-cells. Biochem Pharmacol 77, 101-113.
- Veluthakal R, et al. 2015. Vav2, a guanine nucleotide exchange factor for Rac1, regulates glucose-stimulated insulin secretion in pancreatic beta cells. Diabetologia 58, 2573-2581.
- Shutes A, et al. 2007. Specificity and mechanism of action of EHT 1864, a novel small molecule inhibitor of Rac family small GTPases. J Biol Chem 282, 35666-35678.
- Sidarala V, et al. 2015. EHT 1864, a small molecule inhibitor of Ras-related C3 botulinum toxin substrate 1 (Rac1), attenuates glucose-stimulated insulin secretion in pancreatic ß-cells. Cell Signal 27, 1159-1167.
- Jayaram B, et al 2011. Arf nucleotide binding site opener [ARNO] promotes sequential activation of Arf6, cdc42 and Rac1 and insulin secretion in INS 832/13 beta-cells and rat islets. Biochem Pharmacol 81, 1016-1027.
- Marcusohn J, et al. 1995. The GTP-binding protein Rac does not couple PI3-kinase to insulin-stimulated glucose transport in adipocytes. Curr Biol 5, 1296-1302.
- Sylow L, et al. 2013. Rac1 is a novel regulator of contraction-stimulated glucose uptake in skeletal muscle. Diabetes 62, 1139-1151.
- Sylow L, et al. 2013. Rac1 signaling is required for insulin-stimulated glucose uptake and is dysregulated in insulin-resistant murine and human skeletal muscle. Diabetes 62, 1865-1875.
- Sylow L, et al. 2014. Akt and Rac1 signaling are jointly required for insulin-stimulated glucose uptake in skeletal muscle and downregulated in insulin resistance. Cell Signal 26, 323-331.
- Abo A, et al. 1991. Activation of NADPH oxidase involves the small-GTP binding protein p21rac1. Nature 353, 668-670.
- Pi J, et al. 2007. Reactive oxygen species as a signal in glucose-stimulated insulin secretion. Diabetes 56, 1783-1791.
- Newsholme P, et al. 2009. Insights into the critical role of NADPH oxidase(s) in the normal and dysregulated pancreatic beta cell. Diabetologia 52, 2489-2498.
- Mayo Clinic: http://www.mayoclinic.org/diseases-conditions/diabetes/basics/complications/con-20033091
- Shen E, et al. 2009. Rac1 is required for cardiomyocyte apoptosis during hyperglycemia. Diabetes 58, 2386-2395.
- Li Y-J, et al. 2015. Ras-related C3 botulinum toxin substrate 1 activation is involved in the pathogenesis of diabetic retinopathy. Exp Therap Med 9, 89-97.
- Lv Z, et al. 2013. Rac1/PAK1 signaling promotes epithelial-to-mesenchymal transition of podocytes in vitro via triggering ß-catenin transcriptional activity under high glucose conditions. Int J Biochem Cell Biol 45, 255-264.
活性測定アッセイ
[商品詳細]
- G-LISA® 活性型低分子量Gタンパク質定量キット
- 少量のサンプルから、3時間以内で測定 - 活性型低分子量Gタンパク質 プルダウンアッセイ Biochem Kit™
- プルダウンで簡単に検出 - RhoA / Rac1 / Cdc42 G-LISA 活性型低分子量Gタンパク質アッセイ バンドルキット(24アッセイ/キット)
- お得なセット品!
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Rac1 G-LISA(R) Activation Assay Kit |
CYT | BK126 | 1 KIT [96 assays] |
¥317,000 |
Rac1 G-LISA(R) Activation Assay Kit, Trial Size |
CYT | BK128-S | 24 ASSAY |
¥200,000 |
Rac1 G-LISA(R) Activation Assay Kit |
CYT | BK128 | 1 KIT [96 assays] |
CYT社 BK128L 1 を参照 |
Rac1 Pulldown Activation Assay Kit |
CYT | BK035-S | 1 KIT [20 assays] |
¥132,000 |
Rac1 Pulldown Activation Assay Kit |
CYT | BK035 | 1 KIT [50 assays] |
CYT社 BK035L 1 を参照 |
Combo RhoA/Rac1/Cdc42 Activation Assay Kit |
CYT | BK030 | 1 KIT [3 x 10 assays] |
¥345,000 |
Rac1 抗体
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti Rac1 specific, sample size (Mouse)  |
CYT | ARC03-S | 1*25 UL |
¥38,000 |
Anti Rac1 specific (Mouse)  |
CYT | ARC03 | 2*100 UL |
CYT社 ARC03L 2*100 を参照 |
SOS exchange ドメイン (564-1049) タンパク質
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
SOS1 Ras GEF protein, Human |
CYT | CS-GE02 | 100 UG [1 x 100 μg] |
販売終了 |
SOS1 Ras GEF protein, Human |
CYT | CS-SOS1-B | 1 MG [1 x 1 mg] |
販売終了 |
| SOS1 Ras GEF protein | CYT | CS-SOS1-XL | 1 VIAL |
お問い合わせ |
Signal-Seeker™ キット
[商品詳細]
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Signal-SeekerTM Phosphotyrosine Detection Kit |
CYT | BK160 | 30 ASSAY |
CYT社 BK160L 1 を参照 |
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Signal-SeekerTM Ubiquitin Detection Kit |
CYT | BK161 | 30 ASSAY |
CYT社 BK161L 1 を参照 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













