記事ID : 38311
細胞膜染色用蛍光プローブ CYTOSKELETON NEWS 2020年8月号
細胞膜染色用蛍光プローブ
本ニュースレターでは、一般的に使用されている細胞膜染色用蛍光プローブの特徴について述べ、最新のプローブの飛躍的進歩の概要を紹介します。
細胞膜染色用蛍光プローブは、細胞膜に近接、または細胞膜内で結合することによって、細胞の周辺を可視化します。大きく分けて、小麦胚芽凝集素(Wheat germ agglutinin, WGA)複合体、脂質複合体、脂溶性色素、共有結合プローブ、生物物理学的レポータープローブの5種類の細胞膜染色用蛍光プローブがあります。
神経発生の解明を目的とした1980年代の研究では、神経細胞の形態が最も重要であったため、固定細胞において西洋ワサビペルオキシダーゼ(HRP)結合WGA1が用いられました。しかし、HRPを可視化するのに必要な反応は、生細胞に対して細胞毒性を示しました1)。そこで1986年に、Honigらは、1,1'-ジオクタデシル-3,3,3',3'-テトラメチルインドカルボシアニン過塩素酸塩(DiIC18)と3,3'-ジオクタデシルオキサカルボシアニン過塩素酸塩(DiOC18)の両方を用いることで、カチオン性カルボシアニン色素のパラダイムシフトの有用性を実証し、細胞培養において生きた神経細胞の一部の可視化に成功しました。1989年、当時Zynaxis Cell Science所属のPaul Karl Horanは、細胞染色の一貫性と生存性を高めるための浸透圧調節剤とプロトコルを作成し、シアニン色素の有用性を示す新規キットを開発しました。2000年代初頭に、毒性の低い蛍光結合WGAがWGA-HRPの代替品として使用されるようになりましたが、長期の神経発生研究に必要な安定性と効率は依然として欠けていました1)3)。
近年、MemGlow™ (MemBright™ family4))、Flipper-TR5a)、Nile Red-basedプローブ5b)6)などの新しい蛍光プローブが開発されました。これらのプローブは、膜の構造と機能を今までにない解像度で可視化することが可能で、加えてFlipper-TR、Nile Red-basedプローブは、生物物理学的センサーとして作用することができます。
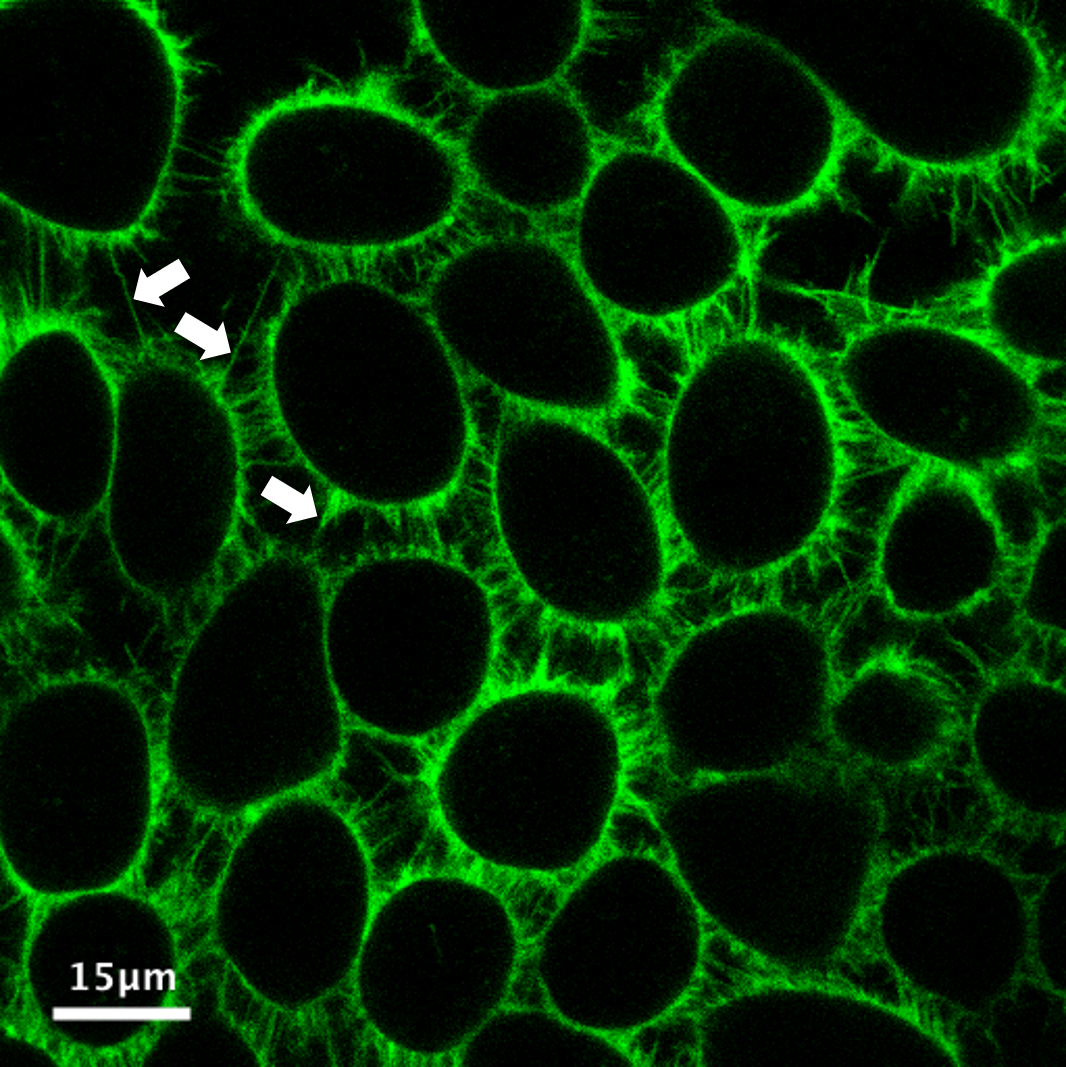
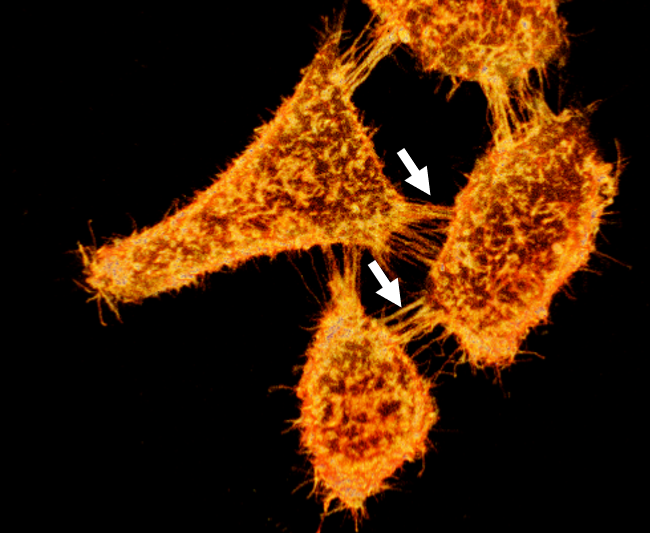
図1 MemGlow™488で標識されたライブHEK293の広視野蛍光イメージング
矢印は、細胞を接続する糸状仮足およびナノチューブチャネルを示す。
画像はM. Collot氏(CNRS, France.)の御厚意により提供。
小麦胚芽凝集素(Wheat germ agglutinin, WGA)
WGAは、細胞表面に存在するグリカンである、N-アセチルグルコサミンとN-アセチルノイラミン酸と優先的に結合するレクチンです7)。これらのグリカンは、一般的にタンパク質に結合しており、その局在によって細胞膜が間接的に可視化されます。現在のWGAマーカーは、Alexa Fluor-conjugationを利用しており、糖鎖の細胞表面マーカーの局在を可視化し、細胞膜を間接的に検出できるようになっています。蛍光色素分子結合型WGAプローブの重要な欠点は、細胞表面の糖鎖が細胞膜の組成によって変化するため、特定の細胞種において細胞間で染色の違いが生じてしまうことです4)8)。さらに、標識WGAは、サイズが大きいため、移動が制限されてしまい、3D細胞培養および組織を効率的に染色することができません。
Paul Karl Horan (PKH)色素
PKH色素は、蛍光色素分子を細胞膜の脂質領域に挿入して固定する炭素鎖を有しています。PKH色素は、生細胞中の細胞膜の特徴付けを可能にしますが、5〜100日の半減期が報告されており、不均一染色を減少させるために長時間のプロトコルおよび独自の等浸透圧試薬を必要とします。シアニンPKH色素は、膜発現因子を必要とせずに細胞膜の特異的標識を可能にします。現在利用可能なPKH色素は、PKH2、PKH26、およびPKH67であり、504 nmから567 nmという限定された範囲の発光スペクトルを有します。PKH色素は、プロトコルにおいて、色素インターカレーションの後に、血清またはBSAタンパク質の添加による色素消光ステップを必要とします9)10)。結合していない色素を消光しなければ、色素が凝集し、共培養に影響を及ぼしたり、細胞を凝集させたりする場合があります。関連して、近年のデータでは、PKH26による標識がエクソソームの膨張を引き起こし、これがエクソソームの生体内分布と細胞取り込みを変化させる可能性があり、研究の結果を混乱させる可能性が示唆されています11)。一般的にPKH標識は、水溶性が乏しいため、有効な膜染色には比較的高濃度を必要とし、非効率的です12)。
長鎖カルボシアニン色素
長鎖脂溶性カルボシアニン色素である、DiI、DiD、DiA、DiR、およびDiOは、広範囲の励起発光スペクトルを持つ、良く知られた細胞膜染色色素およびニューロンの逆行性トレーサーです。3,3'-ジオクタデシルシアニン過塩素酸塩(DiO; DiOC18(3))は501 nm、Dil は565 nm、4-(4-(ジデシルアミノ)スチリル)-N-メチルピリジニウムヨウ化物(4-Di-10-ASP)は、590 nm、1,1'-ジオクタデシル-3,3,3',3'-テトラメチルインドジカルボシアニン過塩素酸塩(DiDオイル; DiIC18(5)オイル)は665 nm、1,1'-ジオクタデシル-3,3,3',3'-テトラメチルインドトリカルボシアニンヨウ化物(DiR; DiIC18(7))は780 nmにおいてピークの蛍光を発します。これらのカルボシアニン色素は、可視スペクトル範囲を広くカバーしていますが、水にはほとんど溶けません。そのため、水溶液中で強く凝集し、細胞膜の染色を十分に行うことができません12)。 例えばDiAが染色できる条件では、DiIは膜を効率的に標識することができますが、DiOは組織を染色することができず、far-red DiDは、点状の染色を生じてしまいます13)。カルボシアニン色素は、細胞透過性を高めるために使用されるTriton-X 100が必要な、共標識用途においても適合しません4)14)。
Advanced Membrane Probes
Advanced Membrane Probesは、これまでに得られなかった高解像度機能を有しています。
MemGlow™
MemGlow™プローブは、リン脂質膜を染色するための新規蛍光プローブです。蛍光性シアニンを基にし、近赤外光を含む広いスペクトル範囲(Abs.max 499〜688nm, Em.max 506〜713)4)で、蛍光波長の異なる5種類のプローブを用意しています。MemGlow™製品は、カルボシアニンペアレント色素の特性を多く有しており、更に細胞応用における一般的な標識製品に比べ、より効果的であることが示されています。MemGlow™色素の利点は、2つの双性イオンアンカーの化学的接着によって強化された、対称シアニンによる化学構造に起因します。両親媒性アンカーは、ミセル凝集体の形で水溶性を改善し、プローブ凝集体の細胞膜への解離とインターカレーションを促進すると同時に、その保持を高めます(図2)。赤色にシフトしたMemGlow™プローブ(MemGlow™590およびMemGlow™700)は、脂溶性の増大およびエンドサイトーシスに対する抵抗性を付与する、付加的な融合ベンゼン環を有しています。
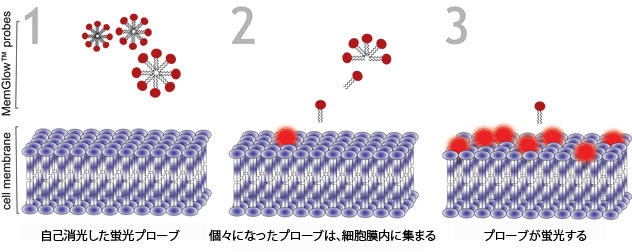
図2 MemGlow™プローブのメカニズム
MemGlow™プローブは、細胞膜とのインターカレーションによって励起が可能になるまで、自己消光されたナノ粒子である。
MemGlow™のアプリケーションはシンプルです。
MemGlow™プローブが水性溶媒に導入されると、細胞膜との接触によって誘発される脂質二重層への解離と分散が生じるまで、両親媒性プローブは自己消光凝集体を形成します。
蛍光発生プローブが組み込まれることにより、バイオイメージングが可能となります。
MemGlow™ 488からMemGlow™ 700までのMemGlow™プローブは、バックグラウンドの何倍も強い蛍光を発し、良好なシグナル対バックグラウンド比を示します4)。
MemGlow™色素は、技術的な進歩により、従来の染色法よりも多くの利点があります(表1)。
1)PKH色素は、複雑なプロトコルを必要とし、生物学的な変化が生じます。
2) 長鎖カルボシアニン色素は、強く凝集するため、可変的で不均一な色素依存特性を有し、Triton X-100による透過処理に不適合です。
3)WGA Alexa標識液は、一貫性のある結果を得るために、細胞表面のグリカンが均一に発現する必要があります。
MemGlow™標識は極めて効率的で、ナノモル濃度でも細胞間の糸状仮足とナノチューブの可視化が可能です(図3)。
図3
生きたKB細胞をMemGlow 488™で染色し、レーザー走査型共焦点顕微鏡でイメージングした3D再現。MemGlow™488、50 nMで5分間染色し、洗浄せずにイメージングした。細胞間糸状仮足とナノチューブが細胞間で見える(白い矢印)。画像はオレンジの偽色で染色。画像はM. Collot氏(CNRS, France)の御厚意により提供。
| プローブ | MemGlow™の優位性 |
|---|---|
| MemGlow™ (Cytoskeleton社) |
|
| DiI, DiO & analogs (long-chain carbocyanines) |
|
| WGA Alexa Fluor |
|
| PKH |
|
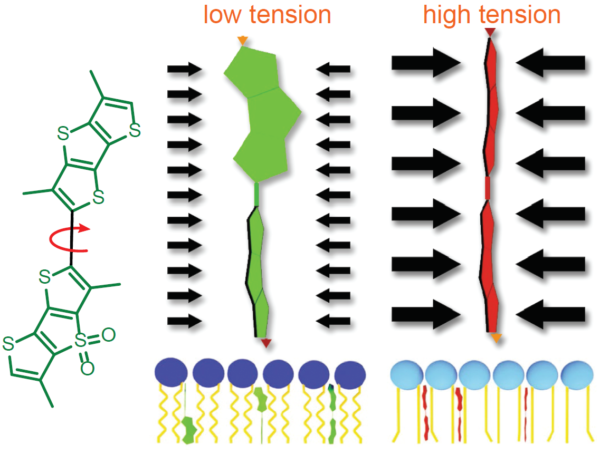
Flipper TR™
膜張力の測定は、実施が困難であり、専門的な訓練が必要です。しかし、現代の蛍光プローブは膜張力測定の利便性が改良されています。Fluorescent LIPid Tension Reporter(Flipper TR™)は生細胞に対する蛍光発生的な膜張力プローブであり、専門的な知識を有する生物物理学者によって開発された高度な技術により、この問題を解決しました 1)。Flipper TR™プローブは、その構造状態によって2種の全く異なる蛍光寿命を示します(図4)。低張力細胞膜に組み込まれたFlipper TR™プローブは半平坦化状態であると想定され、比較的短い蛍光寿命を示します。逆に、膜張力が高い場合、膜リン脂質圧によりFlipper TR™プローブが平坦化した高次構造へと変換し、これにより蛍光寿命が大幅に増大するためFLIM顕微鏡により定量し可視化することができます。Flipper TR™でプローブしたMDCK細胞を、0 から 0.6 mN・m−1の浸透圧刺激により張力を増大させた状態にすると、蛍光寿命スロープΔが2.38 ± 0.18 ns・m・mN−1でした 15)。Flipper TR™プローブは、膜張力だけでなく、膜脂質相や秩序液体 (Lo) または無秩序 (Ld)な状態の脂質を明らかにすることができることから、脂質ラフトを解明する手助けとなることが期待されます。
NRプローブ
NRファミリープローブは、ナイルレッド色素を構造的に増強することにより開発されました。ナイルレッドと同様に、NRプローブは細胞膜に容易に挿入され、発光波長内でソルバトクロミックシフトを経ますが、特徴的な化学構造により増強された性能を持ちます(図5)。NR12Aは長鎖の親油性アルキル鎖、NR4Aは短鎖の親油性アルキル鎖であるスルホン酸基を含む、新規膜標的成分を利用します。またNR12AおよびNR4Aは、その前駆分子に存在する不安定なフェノール類の酸素基は欠如しています。
NR12AとNR4Aは、構造的には類似しているものの、NR4Aはより短鎖のアルキル鎖を持つことから細胞膜結合が容易に可逆できます。単一分子局在化顕微鏡法(SMLM)やナノスケール局所分布において、ナノスケール画像処理用に分光的に分解した点蓄積(SR-PAINT)を介した、細胞膜脂質秩序のナノスケールでの地図作成といった専用アプリケーションに使用されます。SR-PAINTにおいて、より短鎖のアルキル鎖とNR4Aの可逆的結合により、プローブが枯渇すると周囲の細胞培地から未使用の置換プローブを連続的に補充します。興味深いことに、NR4Aを使用することで、生細胞における形質膜陥入現象をナノスケールで動的に解像することができます 5)。これに対し、NR12AやNR12Sに存在するよりも長鎖の親油性アルキル鎖は、準不可逆的な結合を行うため、従来型の顕微鏡法に適しています。大規模な検証を行ったところ、NR12Sは脂質二重膜の外葉に対してより強い偏りを示し、形質膜陥入の内部移行は低く、数時間のうちにわずかな二者間の切り替えのみが認められました6)。NR12Sと、より新型のNR12A類似体を用いることで、困難で侵襲性の、不正確な細胞膜分画化アッセイを行うことなく、リアルタイムで脂質秩序を観察することができます。
以上より、新規蛍光NRプローブは、
1)生細胞画像処理において細胞膜特異性が高い
2)ソルバトクロミック青色シフトによりLo と Ld 局面間を区別が可能
3)それぞれのアプリケーションにおいて良好な光安定性と輝度を示し、バックグラウンドは低い
ことが特徴です。
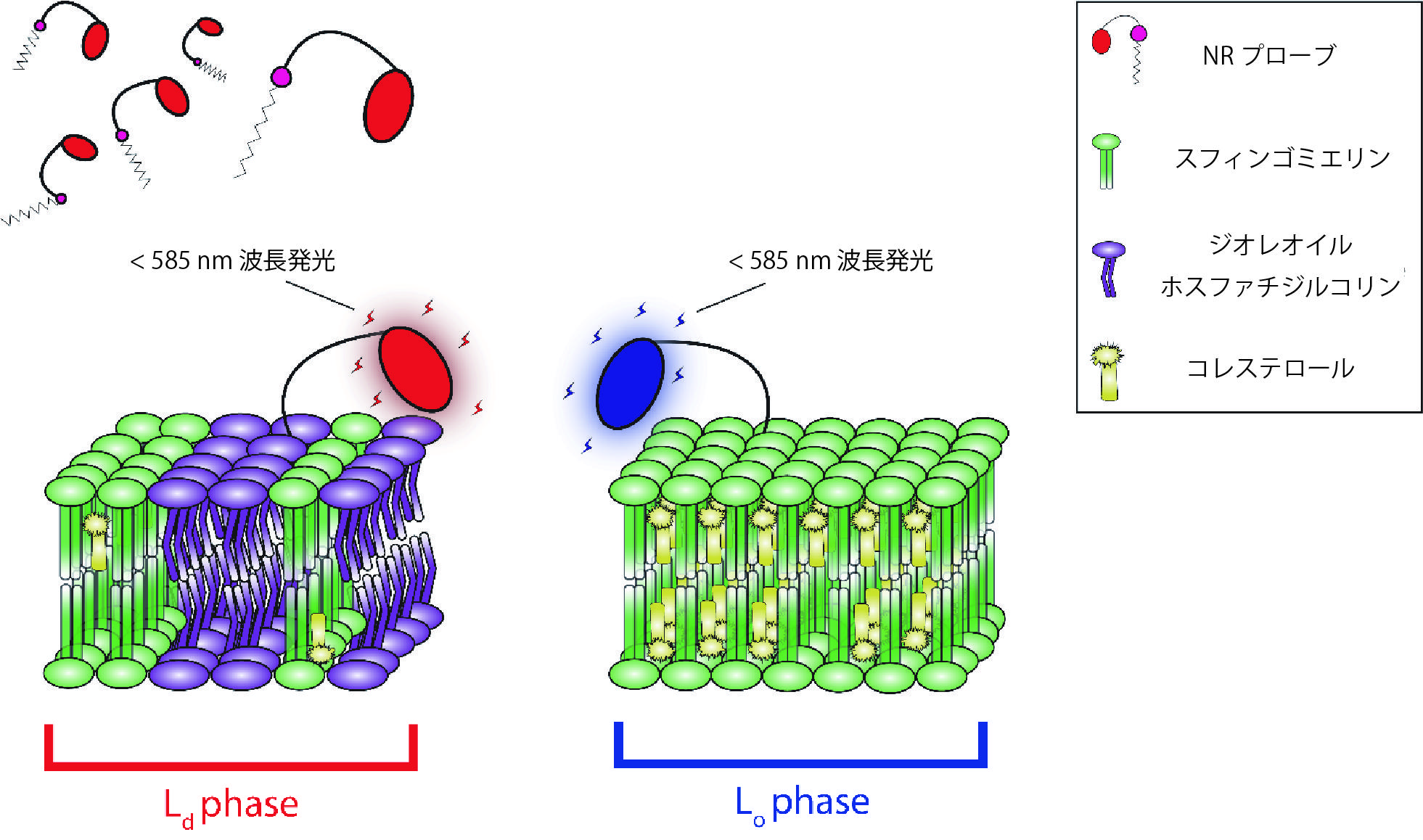
図5 ソルバトクロミックな発光シフトを示すNRプローブ機序の模式図
NRプローブはLd脂質相に組み込まれ585 nm以上の波長で蛍光発光を示す。
これに対し、Lo相では585 nm以下の波長において青色シフト発光を示す。
まとめ
過去40年にわたって、WGA誘導体から脂質類似体、さらに蛍光発生脂質や膜物理的センサーへと細胞膜染色用蛍光プローブが進歩してきました。
現在、最も進化したプローブは、バックグラウンドが低く、低毒性であり、また生物物理学的かつ高解像度の顕微鏡技術に使用されています。
参考文献
1. Honig, M. G. & Hume, R. I. Dil and DiO: versatile fluorescent dyes for neuronal labelling and pathway tracing. Trends Neurosci. 12, 333-341 (1989).
2. Honig, M. G. & Hume, R. I. Fluorescent carbocyanine dyes allow living neurons of identified origin to be studied in long-term cultures. J. Cell Biol. 103, 171-187 (1986).
3. Okun, L. M. Identification and isolation in vitro of neurons marked in situ by retrograde transport. New Approaches Dev. Neurobiol. 109-121 (1981).
4. Collot, M. et al. MemBright: A Family of Fluorescent Membrane Probes for Advanced Cellular Imaging and Neuroscience. Cell Chem. Biol. 26, 600-614.e7 (2019).
5a. Colom A et al. 2018. A fluorescent membrane tension probe. Nat. Chem. 10, 1118-1125.
5b. Danylchuk, D. I., Moon, S., Xu, K. & Klymchenko, A. S. Switchable Solvatochromic Probes for Live-Cell Super-resolution Imaging of Plasma Membrane Organization. Angew. Chemie-Int. Ed. 58, 14920-14924 (2019).
6. Kucherak, O. A. et al. Switchable nile red-based probe for cholesterol and lipid order at the outer leaflet of biomembranes. J. Am. Chem. Soc. 132, 4907-4916 (2010).
7. Bains, G., Lee, R. T., Lee, Y. C. & Freire, E. Microcalorimetric study of wheat germ agglutinin binding to N-acetylglucosamine and its oligomers. Biochemistry 31, 12624-12628 (1992).
8. Wu, Z. L. et al. Differential Distribution of N- and O-Glycans and Variable Expression of Sialyl-T Antigen on HeLa Cells-Revealed by Direct Fluorescent Glycan Imaging. Glycobiology (2020) doi:10.1093/glycob/cwz110.
9. Protocol Guide: Exosome Labeling Using PKH Lipophilic Membrane Dyes | Sigma-Aldrich.
10. Sigma-Aldrich. PKH26 Red Fluorescent Cell Linker Kits for General Cell Membrane Labeling Catalog. in Technical Bulletin 1-4.
11. Dehghani, M., Gulvin, S. M., Flax, J. & Thomas, R. Exosome labeling by lipophilic dye PKH26 results in significant increase in vesicle size. BioRxiv (2019) doi:10.1101/532028.
12. Collot, M. et al. Bright fluorogenic squaraines with tuned cell entry for selective imaging of plasma membrane vs. endoplasmic reticulum. Chem. Commun. 51, 17136-17139 (2015).
13. Thermo Fisher. D282 Documents & Support and Product FAQs | Thermo Fisher Scientific.
14. D275 Documents & Support and Product FAQs | Thermo Fisher Scientific.
15. Colom, A. et al. A fluorescent membrane tension probe. Nat. Chem. 10, 1118-1125 (2018).
Plasma Membrane Probes
Acti-Stain™ Phalloidins
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Acti-stainTM 488 phalloidin, Plant |
CYT | PHDG1-A | 1*500 UL [300 slides] |
¥74,000 |
Acti-stainTM 555 phalloidin, Mushroom |
CYT | PHDH1-A | 1*500 UL [300 slides] |
¥74,000 |
Acti-stainTM 670 phalloidin, Plant |
CYT | PHDN1-A | 1*500 UL [300 slides] |
¥74,000 |
Phalloidin; Fluorescent Derivatives (Acti-StainTM 535), Rhodamine Isothiocyanate |
CYT | PHDR1 | 1*500 UL [300 slides] |
¥74,000 |
Actin Biochem Kits
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Actin Binding Protein Spin-down Biochem Kit (for muscle) |
CYT | BK001 | 1 KIT [30-100 assays] |
¥254,000 |
Actin Polymerization Biochem Kit, Rabbit |
CYT | BK003 | 1 KIT [30-100 assays] |
¥288,000 |
Actin Binding Protein Spin-Down Biochem Kit (Non-muscle) |
CYT | BK013 | 1 KIT [30-100 assays] |
¥257,000 |
G-Actin : F-Actin In Vivo Assay Kit, Mouse |
CYT | BK037 | 1 KIT [30-100 assays] |
¥250,000 |
Signal Seeker™ Kits
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Signal-SeekerTM Phosphotyrosine Detection Kit |
CYT | BK160 | 30 ASSAY |
¥239,000 |
Signal-SeekerTM Ubiquitin Detection Kit |
CYT | BK161 | 30 ASSAY |
¥239,000 |
Signal-SeekerTM SUMOylation Detection Kit |
CYT | BK162 | 30 ASSAY |
¥239,000 |
Signal-SeekerTM Acetyl-Lysine Detection Kit |
CYT | BK163 | 30 ASSAY |
¥239,000 |
Tubulin Kits
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Tubulin Polymerization Assay Kit, Porcine |
CYT | BK004P | 1 KIT [24 assays] |
¥209,000 |
Tubulin Polymerization Assay Kit |
CYT | BK006P | 1 KIT [24 assays] |
¥298,000 |
Microtubule Binding Protein Spin Down Assay Kit |
CYT | BK029 | 1 KIT [30-100 assays] |
¥251,000 |
Live Cell Imaging Products
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
SiR-Actin Kit |
CYT | CY-SC001 | 1 KIT [50-300 slides] |
¥180,000 |
SiR-Tubulin Kit |
CYT | CY-SC002 | 1 KIT [50-300 slides] |
¥180,000 |
Cytoskeleton Kit (SiR-Actin + SiR-Tubulin) |
CYT | CY-SC006 | 1 KIT [50-300 slides] |
販売終了 |
SiR-DNA Kit |
CYT | CY-SC007 | 1 KIT [50-300 slides] |
¥119,000 |
SiR-Lysosome Kit |
CYT | CY-SC012 | 1 KIT [50-300 slides] |
¥130,000 |
SiR700-Actin Kit |
CYT | CY-SC013 | 1 KIT [35-200 slides] |
¥180,000 |
SiR700-Tubulin Kit |
CYT | CY-SC014 | 1 KIT [35-200 slides] |
¥180,000 |
SiR700-DNA Kit |
CYT | CY-SC015 | 1 KIT [35-200 slides] |
¥119,000 |
SPY555-Actin Probe |
CYT | CY-SC202 | 1 VIAL [100 slides] |
¥158,000 |
SPY505-DNA Probe |
CYT | CY-SC101 | 1 VIAL [100 slides] |
¥119,000 |
SPY555-DNA Probe |
CYT | CY-SC201 | 1 VIAL [100 slides] |
¥119,000 |
SPY555-Tubulin Probe |
CYT | CY-SC203 | 1 VIAL [100 slides] |
¥158,000 |
SPY595-DNA Probe |
CYT | CY-SC301 | 1 VIAL [100 slides] |
¥119,000 |
SPY650-DNA Probe |
CYT | CY-SC501 | 1 VIAL [100 slides] |
¥119,000 |
SPY650-Tubulin Probe |
CYT | CY-SC503 | 1 VIAL [100 slides] |
¥158,000 |
SPY700-DNA Probe |
CYT | CY-SC601 | 1 VIAL [100 slides] |
¥119,000 |
Actin Protein (rhodamine, skeletal muscle), Rabbit, Rhodamine Isothiocyanate |
CYT | AR05-B | 10*20 UG |
¥98,000 |
Actin Protein (rhodamine, skeletal muscle), Rabbit, Rhodamine Isothiocyanate |
CYT | AR05-C | 20*20 UG |
¥189,000 |
Actin Protein (rhodamine, platelet non-muscle), Human, Rhodamine Isothiocyanate |
CYT | APHR-A | 4*10 UG |
¥101,000 |
Actin Protein (rhodamine, platelet non-muscle), Human, Rhodamine Isothiocyanate |
CYT | APHR-C | 20*10 UG |
¥321,000 |
Labeled Actin Proteins
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Actin Protein (biotin, skeletal muscle), Rabbit, Biotin |
CYT | AB07-A | 5*20 UG |
¥113,000 |
Actin Protein (biotin, skeletal muscle), Rabbit, Biotin |
CYT | AB07-C | 20*20 UG |
¥326,000 |
Actin Protein (pyrene, skeletal muscle), Rabbit |
CYT | AP05-A | 1*1 MG |
¥69,000 |
Actin Protein (pyrene, skeletal muscle), Rabbit |
CYT | AP05-B | 5*1 MG |
¥324,000 |
Actin Protein (rhodamine, platelet non-muscle), Human, Rhodamine Isothiocyanate |
CYT | APHR-A | 4*10 UG |
¥101,000 |
Actin Protein (rhodamine, platelet non-muscle), Human, Rhodamine Isothiocyanate |
CYT | APHR-C | 20*10 UG |
¥321,000 |
Actin Protein (rhodamine, skeletal muscle), Rabbit, Rhodamine Isothiocyanate |
CYT | AR05-B | 10*20 UG |
¥98,000 |
Actin Protein (rhodamine, skeletal muscle), Rabbit, Rhodamine Isothiocyanate |
CYT | AR05-C | 20*20 UG |
¥189,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する