記事ID : 17802
PTEN(Phosphatase and Tensin Homolog)による翻訳後制御 CYTOSKELETON NEWS 2017年4月号

PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
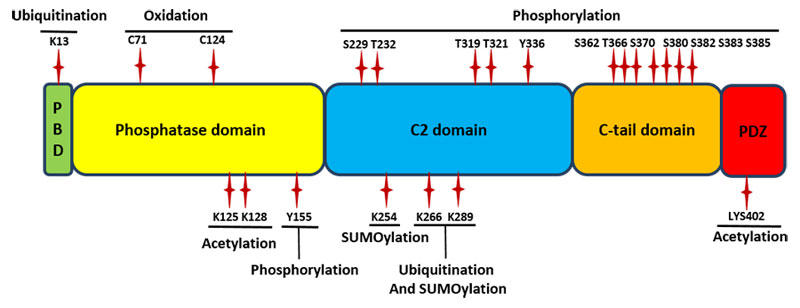
ホスファチジルイノシトール3,4,5-三リン酸の脱リン酸化反応を触媒する酵素PTENは、癌抑制タンパク質であることが20年前に二つの研究所により報告されました1。PTENは、細胞の接着や遊走、増殖、成長、生存などの多様な機能を制御することでも知られています。PTENは5種のドメインから成っており、N末端側からPIP2結合ドメイン(PBD)、テンシンと相動性を持ちPTENの酵素活性中心となるホスファターゼドメイン、生体膜のリン脂質と結合するC2ドメイン、C末端ドメインとなり、C末端側はPDZ結合ドメインで終わります2(図1)。PTENの生体膜上のPIP3をPIP2に転換するホスファターゼ活性は、細胞の生存や増殖におけるPI3K/Aktシグナル経路を負に制御することで癌抑制因子として働いています1-3。
PTENの発現と酵素活性は、転写・転写後・翻訳後それぞれにおいて厳密に制御されています3。実際に、PTENのリン酸化、ユビキチン化、SUMO化、アセチル化、酸化などの翻訳後修飾(PTM:Post-Translational Modification)によりその安定性や活性、局在、他タンパク質との相互作用などを変化させるデータは豊富にあります。PTENの翻訳後制御の欠損はPTEN活性を失わせますが、これは正常細胞と比較して癌細胞においてしばしば起きていると考えられます。臨床的にもPTENの変異や機能的な欠失が多種の癌において広く見つかっています。本稿では、翻訳後修飾によるPTENの制御について論じています。
リン酸化
PTENのドメインでは少なくとも3種以上のドメインにおいて様々なキナーゼに仲介されるリン酸化部位が多量に見つかっています(図1)。C末端ドメインでは、PTENのリン酸化がPTEN活性の制御に重要な役割を果たしています。Ser362 と Thr366 はグリコーゲン合成酵素キナーゼ 3β によりリン酸化されます4,5。カゼインキナーゼ2は Ser370 と Ser385 をリン酸化し4,5、また Ser380 や Thr382、Thr383 をわずかに修飾するという報告もあります5(異なる報告もあります。Al-Khouri et al. を参照4)。C末端のリン酸化されたPTENは構造的に閉じており、生体膜上のリン脂質や膜アンカー型タンパク質との結合は阻害されます6。細胞膜への結合能を欠失したPTENは膜上の基質であるPIP3に対して活性を持ちません。興味深いことに、リン酸化され閉じた構造のPTENは、ユビキチンリガーゼに対する感受性が下がりプロテアソームによる分解も受けにくくなります5。
PTENのC2ドメインでもリン酸化は起こります(図1)。RAKは Src チロシンキナーゼファミリーの一つで、Tyr336 をリン酸化することによりPTEN活性を向上させます。これによりPTENはE3リガーゼNEDDとの相互作用が阻害され4-1、ポリユビキチン化やプロテアソームによる分解から守られます7。また、Rho結合キナーゼ(ROCK)はRho GTPaseシグナル経路の下流エフェクター分子であり、PTENの Ser229、Thr232、Thr319、Thr321 をリン酸化します。これらの修飾はPTENの細胞内局在やPTENを介した走化性を制御しています9。
PTENのホスファターゼドメインでは、Tyr155 のリン酸化がE3リガーゼWWP2とPTENの結合を促進し、ユビキチン化依存的な分解を仲介します8。このリン酸化を行うキナーゼについてはまだ報告されていません。
ユビキチン化とSUMO化
PTENのポリユビキチン化は細胞基質におけるプロテアソーム分解の原因となりますが、PTENの Lys13 や Lys289 部位のモノユビキチン化はPTENの核内への局在化を促進し、AKT活性を中和することで癌抑制の機能を果たします10(図1)。Lys266 もまたモノユビキチン化されることがわかっています11。また、PTENのリシン残基はSUMO1とSUMO2/3によりSUMO化されます11-13。Lys254 と Lys266 はSUMO1によってSUMO化され12、Lys289 もSUMO化が報告されています11。SUMO1修飾はPTENと生体膜との相互作用を向上させ、その基質であるPIP3との結合も促進させます12。SUMO2/3修飾されたPTENは核内に局在し、DNA修復を制御します13。
アセチル化
PTENのホスファターゼ活性ドメインはアセチル化修飾を受けます(図1)。Lys125 と Lys128 のアセチル化は、基質であるPIP3との結合に影響することでPTENのホスファターゼ活性を阻害します14。もう一つのアセチル化部位はC末端側のPDZ結合ドメインにおける Lys402 ですが、PTENの機能や局在におけるその影響はまだ明らかとなっていません15。
酸化
酸化はPTEN機能を制御するもう一つの翻訳後修飾と見られています。PTENのホスファターゼドメインにおける Cys124 の H2O2 を介した酸化は、Cys124 と Cys71 の間のジスルフィド結合の形成を誘導し、PTENのホスファターゼ活性を減少させます16(図1)。動物研究において、PRDX1(peroxidase peroxiredoxin1)を欠損しているマウスでは異常量の活性酸素による腫瘍の発達への高い感受性が認められており、これはPTENの酸化による不活化とAKT経路の過剰な活性化によるものであることが示されています17。通常ではPRDX1はPTENと結合しPTENが酸化することを防いでいます17。
まとめ
翻訳後修飾の研究は、研究者たちにタンパク質制御に関する新しい視点を提供し、ヒト疾患に対する新しい治療標的を見つけていく上で極めて重要なものです。Cytoskeleton社では、標的タンパク質の翻訳後修飾の研究に必要なツールとして、包括的かつ使いやすい Signal Seeker™ キットを提供しております。最近の研究では、EGF処理した A431 細胞において、このキットを用いてPD-L1の新しいモノユビキチン化が発見されています18。
参考文献
- Shi Y. et al. 2012. PTEN at a glance. J. Cell Sci. 125, 4687-4692.
- Lee J.O. et al. 1999. Crystal structure of the PTEN tumor suppressor: Implications for its phosphoinositide phosphatase activity and membrane association. Cell. 99, 323-324.
- Song M.S. et al. 2012. The functions and regulation of the PTEN tumor suppressor. Nat. Rev. Mol. Cell Biol. 13, 283-296.
- Al-Khouri A.M. et al. 2005. Cooperative phosphorylation of the tumor suppressor phosphatase tensin homologye (PTEN) by casein kinases and glycogen synthase kinase 3beta. J. Biol. Chem. 280, 35195-35202.
- Torres J. and Pulido R. 2001. The tumor suppresspr PTEN is phosphorylated by the protein kinase CK2 at its C terminus. Implications for PTEN stability to proteasome-mediated degradation. J. Biol. Chem. 276, 993-998.
- Rahdar M. et al. 2009. A phosphorylation-dependent intramolecular interaction regulates the membrane association and activity of the tumor suppressor PTEN. Proc. Natl. Acad. Sci. USA. 106, 480-485.
- Yim E.K. et al. 2009. Rak functions as a tumor suppressor by regulating PTEN protein stability and function. Cancer Cell. 15, 304-314.
- Maddika S. et al. 2011. WWP2 is an E3 ubiquitin ligase for PTEN. Nat. Cell Biol. 13, 728-733.
- Li Z. et al. 2005. Regulation of PTEN by Rho small GTPases. Nat. Cell Biol. 7, 399-404.
- Trotman L.C. et al. 2007. Ubiquitination regulates PTEN nuclear import and tumor suppression. Cell. 128, 141-156.
- González-Santamaría J. et al. 2012. Regulation of the tumor suppressor PTEN by SUMO. Cell Death Dis. 3, e393.
- Huang J. et al. 2012. SUMO1 modification of PTEN regulates tumorigenesis by controlling its association with the plasma membrane. Nat. Commun. 3, 911.
- Bassi C. et al. 2013. Nuclear PTEN controls DNA repair and sensitivity to genotoxic stress. Science. 341, 395-399.
- Okumura K. et al. 2006. PCAF modulates PTEN activity. J. Biol. Chem. 281, 26562-26568.
- Ikenoue T. et al. 2008. PTEN acetylation modulates its interaction with PDZ domain. Cancer Res. 68, 6908-6912.
- Cho S.H. et al. 2004. Redox regulation of PTEN and protein tyrosine phosphatases in H2O2-mediated cell signaling. FEBS Lett. 560, 7-13.
- Cao J. et al. 2009. Prdx1 inhibits tumorigenesis via regulating PTEN/AKT activity. EMBO J. 28, 1505-1517.
- Horita H. et al. 2017. Identifying regulatory posttranslational modifications of PD-L1: A focus on monoubiquitinaton. Neoplasia. 19, 346-353.
- Xu W. et al. 2014. Posttranslational regulation of phosphatase and tensin homolog (PTEN) and its functional impact on cancer behaviors. Drug Des. Devel. Ther. 8, 1745-1751.
Signal Seeker™ キット
[商品詳細]
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Signal-SeekerTM Phosphotyrosine Detection Kit |
CYT | BK160 | 30 ASSAY |
CYT社 BK160L 1 を参照 |
Signal-SeekerTM SUMOylation Detection Kit |
CYT | BK162 | 30 ASSAY |
CYT社 BK162L 1 を参照 |
Signal-SeekerTM Ubiquitin Detection Kit |
CYT | BK161 | 30 ASSAY |
CYT社 BK161L 1 を参照 |
翻訳後修飾抗体、ビーズ、など
[商品詳細]
- SUMO-2/3 アフィニティービーズ
- 免疫沈降(IP)によるSUMO化タンパク質の濃縮に最適
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Anti Phosphotyrosine Affinity Beads, (Mouse) , 27B10.4 |
CYT | APY03-BEADS | 4*300 UL |
CYT社 APY03BEADS 4*330 を参照 |
Anti SUMO-2/3 Affinity Beads, (Mouse) , 11G2 |
CYT | ASM24-BEADS | 800 UL [2 x 400 μl] |
CYT社 ASM24BEADSA 2*400 を参照 |
Control for Ippt IgG beads |
CYT | CIG01-BEADS | 10 ASSAY |
CYT社 CIG01BEADS10 10 を参照 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する