
記事ID : 11450
アクチンが引き起こす膜突起による浸潤:コルタクチン CYTOSKELETON NEWS 2013年7月号

アクチンが引き起こす膜突起による浸潤:コルタクチン
コルタクチンの複数のシグナリングドメイン
アクチン結合タンパク質であるコルタクチンは、樹状(分枝など)アクチンネットワークに依存する細胞膜の変化などの、細胞の機能に重要ないくつかの役割(糸状仮足による細胞運動性、クラスリン依存又は非依存エンドサイトーシス、ホスト-病原体相互作用、内皮バリア完全性の維持、浸潤突起媒介細胞浸潤1)を果たしています。 コルタクチンは、80kDaの単量体のタンパク質で、細胞表層の皮質性アクチンとの細胞内共局在から名づけられました2。コルタクチンのN末端にある、酸性アミノ酸の豊富なドメイン(N-terminal acidic domain;NTA)は、アクチンフィラメントの枝分かれを促進するArp2/3複合体の7つのサブユニットと相互作用します3。コルタクチンのNTAドメインは、他の既知のアクチン核化促進因子(NPF)のArp2/3結合領域に見られるDDW(Asp-Asp-Trp)モチーフを含んでいます(例:WASP、N-WASP、Myo3、ActAのDDW又はDEWモチーフ)4(図1)。
NPFは、Arp2/3が媒介する繊維状アクチン(F-アクチン)の分枝促進における役割に基づいて、2つにクラス分けされます5。クラスIのNPFは、上述のように、線維を分枝させるArp2/3の活性化を促進し、クラスIIのNPFは、コルタクチンの機能と同様で、アクチン凝集の分枝形成及びその安定化の機能を持ちます6,7。コルタクチンはArp2/3媒介F-アクチン分枝を直接活性化できますが、クラスIのNPFで見られる活性よりもかなり弱い活性しかありません6。これは、1つには、クラスIのNPFにはある球状アクチン(G-アクチン)結合ドメインが、コルタクチンには欠けていることによります5。枝分かれしたフィラメントを安定化する役割と一致して、コルタクチンには37残基配列のF-アクチン結合ドメインを6.5回繰り返すセントラルドメインがあります2,4(図1)。このドメインの隣に、複数の翻訳後修飾(posttranslational modifications;PTM)部位を持つヘリカルドメイン及びプロリンリッチドメインがあります。さらにその隣に、SH3ドメイン(フィラメントの分枝点で、Arp2/3複合体にクラスI NPFであるN-WASPなどの他のタンパク質を召集する部位)があります(結合パートナーのリストは、参考文献8をご参照ください)。
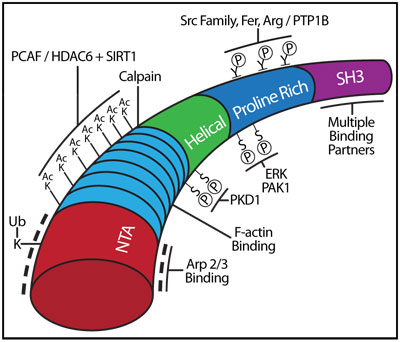
図1 コルタクチンの一次構造の模式図
主な翻訳後修飾部位と結合ドメインを示す。
悪性腫瘍とコルタクチンの関係性
浸潤突起として知られるF-アクチンリッチな細胞突出は、元々はヒトの腫瘍細胞株で同定され、その浸潤する性質から名づけられました9。浸潤突起は、直径0.8-1μm、長さ2-5μmの膜の拡張部で、細胞外マトリクス(ECM)に接する基底膜に見られます10。コルタクチンは、浸潤突起の形成に不可欠で、ECMの分解を促進し、細胞を近接する組織に浸潤させるために、マトリクスメタロプロテアーゼが集中して供給されます10-12。いくつかのヒトの癌(乳癌、結腸癌、卵巣癌、肝臓癌、胃癌、食道癌、メラノーマ、グリオブラストーマなど)では、コルタクチンの発現が高くなっていることが示されました8,13。従って、コルタクチンは、悪性転移性腫瘍の重要なバイオマーカーとなりつつあり、その発現高進は、多くの場合患者の予後の悪化に関係しています。
コルタクチンの翻訳後修飾の重要性
コルタクチン活性のPTMによる調節は、非常に複雑で、異なるPTM間で高度に相互干渉していることがわかってきました。1つもしくはそれ以上のキナーゼ(ERK、PAK1、PKD1)による、4つのセリン残基(S405、S418、S298、S348)のリン酸化は、コルタクチンの活性を調節します8。プロリンリッチドメインにあるS405/S418のERKによるリン酸化は、形態的変化を誘導してSH3ドメインを暴露させ、クラスIのNPFであるN-WASP又はWASPと結合、活性化すると考えられています14。対照的に、Srcファミリーキナーゼ(おそらくはこれ以外のキナーゼも含まれる)による、Y421、Y466、Y482チロシン残基のリン酸化15,16は、コルタクチンの、直接的または間接的(N-WASP又はWASPの活性化及び召集による)なArp2/3媒介F-アクチン分枝活性を欠損させます14,17。この、セリン・チロシンリン酸化の相互関係は、「S-Yスイッチ」と呼ばれています18。
コルタクチンのセリン・チロシン両方のリン酸化が、自身の分解のシグナルとして機能していることは興味深いことです。前述のセリンのERKによるリン酸化は、コルタクチンとE3リガーゼ複合体のβTrcpサブユニットとの相互作用を解してK79をユビキチン化させ、最終的にプロテオソーム分解を引き起こします19。同じように、コルタクチンのチロシンのリン酸化は、カルシウム依存プロテアーゼカルパインによる自身の分割のためのシグナルになります20。コルタクチンの、F-アクチンと相互作用してArP2/3を活性化させる能力は、リジンのアセチル化/脱アセチル化(それぞれPCAF及びHDAC6によって部分的に調節される)によっても調節されています21。興味深いことに、最近の報告では、チロシンのリン酸化とリジンのアセチル化は、両PTMともにコルタクチン活性に負の影響を与えるにも関わらず、競合関係があるということもわかってきました22。このことは、コルタクチンのPTMの相互干渉における複雑性に、まだ他の存在があることを暗示しています。そして、相互作用するこれらのシグナル伝達経路が、アクチンフィラメントの分岐点で、コルタクチンを調節するためにどのように収束しているかは、興味深い研究対象となるでしょう。
Cytoskeleton社は、コルタクチンの生理学的機能を更に解明するために、高純度のアクチン及びアクチン関連タンパク質などのアクチン研究ツールをご提供致します。
参考文献
1. Cosen-Binker LI and Kapus A. 2006. Cortactin: The gray eminence of the cytoskeleton. Physiology. 21: 352-361.
2. Wu H and Parsons JT. 1993. Cortactin, an 80/85-Kilodalton pp60 src substrate, is a filamentous actin-binding protein enriched in the cell cortex. J. Cell Biol. 120: 1417-1426.
3. Mullins RD et al. 1998. The interaction of the Arp2/3 complex with actin: nucleation, high affinity pointed end capping, and formation of branching networks of actin filaments. Proc. Natl. Acad. Sci. USA. 95: 6181-6186.
4. Weed SA et al. 2000. Cortactin localization to sites of actin assembly in lamellipodia requires interactions with F-actin and the Arp2/3 complex. J. Cell Biol. 151:29-40.
5. Goley ED and Welch MD. 2006. The Arp2/3 complex: an actin nucleator comes of age. Nat. Rev. Mol. Cell Biol. 7: 713-726.
6. Weaver AM et al. 2001. Cortactin promotes and stabilizes Arp2/3-induced actin filament network formation. Curr. Biol. 11: 370-374.
7. Egile C et al. 2005. Mechanism of filament nucleation and branch stability revealed by the structure of the Arp2/3 complex at actin branch junctions. PLoS Biol. 3: 1902-1909.
8. Kirkbride KC et al. 2011. Cortactin a multifunctional regulator of cellular invasiveness. Cell Adh. Migr. 5: 187-198.
9. Chen WT. 1989. Proteolytic activity of specialized surface protrusions formed at rosette contact sites of transformed cells. J. Exp. Zool. 251: 167-185.
10. Artym VV et al. 2006. Dynamic interactions of cortactin and membrane type 1 matrix metalloproteinase in invadopodia: defining the stages of invadopodia formation and function. Cancer Res. 66: 3034-3043.
11. Clark ES and Weaver AM. 2008. A new role for cortactin in invadopodia: Regulation of protease secretion. Eur. J. Cell Biol. 87: 581-590.
12. Clark ES et al. 2007. Cortactin is an essential regulator of matrix metalloprotease secretion and extracellular matrix degradation in invadopodia. Cancer Res. 67: 4227-4235.
13. MacGrath SM and Koleske AJ. 2012. Cortactin in cell migration and cancer at a glance. J. Cell Sci. 125: 1621-1626.
14. Martinez-Quiles N et al. 2004. Erk/Src phosphorylation of cortactin acts as a switch onswitch off mechanism that controls its ability to activate N-WASP. Mol. Cell Biol. 24: 5269- 5280.
15. Sangar W et al. 2007. Fer-mediated cortactin phosphorylation is associated with efficient fibroblast migration and is and is dependent on reactive oxygen species generation during integrin-mediated cell adhesion. Mol. Cell Biol. 27: 6140-6152.
16. Boyle SN et al. 2007. A critical role for cortactin phosphorylation by Abl-family kinases in PDGF-induced dorsal-wave formation. Curr Biol. 17: 445-451.
17. Huang C et al. 1997. Down-regulation of the filamentous actin cross-linking activity of cortactin by Src-mediated tyrosine phosphorylation. J. Biol. Chem. 272: 13911-13915.
18. Lua BL and Low BC. 2005. Cortactin phosphorylation as a switch for actin cytoskeleton network and cell dynamics control. FEBS Lett. 579: 577-585.
19. Zhao J et al. 2012. Extracellular signal-regulating kinase (ERK) regulates cortactin ubiquitination and degradation in lung epithelial cells. J. Biol. Chem. 287: 19105-19114.
20. Huang C et al. 1997. Proteolysis of platelet cortactin by calpain. J. Biol. Chem. 272: 19248-19252.
21. Zhang X et al. 2007. HDAC6 modulates cell motility by altering the acetylation level of cortactin. Mol. Cell. 27: 197-213.
22. Meiler E et al. 2012. Cortactin tyrosine phosphorylation promotes its deacetylation and inhibits cell spreading. PLoS ONE. 7: e33662.
アクチン関連研究ツール タンパク質
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
Actin protein (rabbit skeletal muscle, >99% pure), Rabbit, Unlabeled |
CYT | AKL99-A | 4*250 UG |
¥68,000 |
Actin protein (rabbit skeletal muscle, >99% pure), Rabbit, Unlabeled |
CYT | AKL99-B | 2*1 MG |
¥81,000 |
Actin Protein (platelet non-muscle, >99% pure), Human, Unlabeled |
CYT | APHL99-A | 2*250 UG |
¥74,000 |
Actin Protein (platelet non-muscle, >99% pure), Human, Unlabeled |
CYT | APHL99-C | 1*1 MG |
¥125,000 |
Pre-formed actin filaments (rabbit skeletal muscle), Rabbit |
CYT | AKF99-A | 1*1 MG |
¥63,000 |
Pre-formed actin filaments (rabbit skeletal muscle), Rabbit |
CYT | AKF99-B | 5*1 MG |
¥227,000 |
Actin Protein (pyrene, skeletal muscle), Rabbit |
CYT | AP05-A | 1*1 MG |
¥69,000 |
Actin Protein (pyrene, skeletal muscle), Rabbit |
CYT | AP05-B | 5*1 MG |
¥324,000 |
Actin Protein (biotin, skeletal muscle), Rabbit, Biotin |
CYT | AB07-A | 5*20 UG |
¥113,000 |
Actin Protein (biotin, skeletal muscle), Rabbit, Biotin |
CYT | AB07-C | 20*20 UG |
¥326,000 |
アクチン関連研究ツール キット
| 品名 | メーカー | 品番 | 包装 | 希望販売価格 |
|---|---|---|---|---|
G-Actin : F-Actin In Vivo Assay Kit, Mouse |
CYT | BK037 | 1 KIT [30-100 assays] |
¥250,000 |
Actin Binding Protein Spin-Down Biochem Kit (Non-muscle) |
CYT | BK013 | 1 KIT [30-100 assays] |
¥257,000 |
Actin Polymerization Biochem Kit, Rabbit |
CYT | BK003 | 1 KIT [30-100 assays] |
¥288,000 |
■ CYTOSKELETON NEWS バックナンバー
- 2020年10月号 紡錘体 - 可視化に向けた新規ツール
- 2020年8月号 細胞膜染色用蛍光プローブ
- 2020年4月号 生細胞におけるF-アクチンプローブ
- 2020年3月号 コロナウイルスと細胞骨格
- 2020年2月号 タウ(Tau)の将来性をMapping
- 2020年1月号 Rho GTPaseによる細胞遊走制御
- 2019年12月号 表現型プロファイリング:アクチンに焦点を当てたがん治療
- 2019年11月号 チューブリンの過剰グルタミル化、ミトコンドリア、神経変性
- 2019年9月号 細胞運動性を制御するために相互作用する膜張力とアクチン細胞骨格
- 2019年8月号 Rac1B、がん、およびRac1
- 2019年7月号 Rhoファミリー GTPases、神経可塑性、およびうつ状態
- 2019年6月号 アクチンメチオニン酸化: 動的制御の次の段階
- 2019年5月号 ミクログリアと神経変性疾患
- 2019年2月号 生細胞画像化に対するCNS疾患や障害
2018年
- 2018年12月号 アクチン細胞骨格とメカノトランスダクション(機械的シグナル伝達)
- 2018年11月号 軸索再生と細胞骨格
- 2018年10月号 ニューロンにおける微小管と極性
- 2018年8月号 Rab GTPase と 神経変性
- 2018年7月号 SUMO レスリング: バランスが全て
- 2018年6月号 なぜ K-Ras は発がん特異性を示すのか?
- 2018年5月号 治療標的としてのユビキチンプロテアソームシステム:チューブリンは関与するか?
- 2018年4月号 RhoファミリーGEFと樹状突起スパインの構造的可塑性
- 2018年3月号 βカテニンとTFC/LEF-1の翻訳後修飾による標準的なWntシグナル制御
- 2018年2月号 がん抑制遺伝子p53の翻訳後修飾による機能の調整
- 2018年1月号 自閉スペクトラム症におけるGEF Trioの役割
2017年
- 2017年12月号 プロフィリン: アクチン結合タンパク質の多機能な役割
- 2017年11月号 ミトコンドリアにおけるアセチル化:新たな考え方と治療への応用の可能性
- 2017年9月号 翻訳後修飾のアセチル化による微小管の安定化
- 2017年8月号 神経軸索におけるアクチンリングを基盤とした周期的膜骨格(PMS)
- 2017年7月号 E3ユビキチンリガーゼMdm2によるがん抑制遺伝子p53の翻訳後制御
- 2017年6月号 多能性幹細胞(PSC)での転写因子による翻訳後制御
- 2017年5月号 Arf6 GEF と癌細胞の浸潤・転移
- 2017年4月号 PTEN(Phosphatase and Tensin Homolog)による翻訳後制御
- 2017年3月号 Tau の翻訳後修飾: アルツハイマー病の治療標的
- 2017年2月号 樹状細胞の移動におけるアクチン結合タンパク質とF-アクチン
2016年
- 2016年11月/12月号 GEF を介した GTPase シグナル伝達の低分子阻害剤
- 2016年9月号 FtsZ タンパク質: 抗菌薬の新規ターゲット
- 2016年7月号 翻訳後修飾(PTM)は心臓病において細胞骨格タンパク質を調節する
- 2016年6月号 モータータンパク質キネシンと神経変性
- 2016年5月号 チロシンリン酸化は Rhoファミリー GTPase 活性を調節する
- 2016年4月号 Rac1と糖尿病: ポジティブな役割とネガティブな役割
- 2016年3月号 SUMO化: 細胞骨格タンパク質の機能を調節するレギュレーター
- 2016年1月/2月号 ビメンチン中間径フィラメント: リン酸化による調節
2015年
- 2015年8月号 タンパク質調節に不可欠な翻訳後修飾
- 2015年7月号 アクチン細胞骨格のライブセルイメージング
- 2015年6月号 有糸分裂に関わるタンパク質のSUMO化: 局在と機能
- 2015年5月号 Ras 癌の治療: 5つの有望なターゲット
- 2015年4月号 Ras 依存性の癌で注目される YAP1
- 2015年3月号 増刊号 統合失調症において遺伝子変異により誘導されるアクチン依存のシナプスの変化
- 2015年3月号 Ral GTPase を調節する翻訳後修飾
- 2015年1月/2月号 RhoA のリン酸化はシグナル伝達を調節する
- 2015年1月号 増刊号 微小管を不安定化する suprafenacine: 新規抗癌剤のリード化合物としての可能性
2014年
- 2014年12月号 増刊号 RhoA は心筋細胞におけるアクチン細胞骨格の再構成とグルコース取り込みを仲介する
- 2014年11月号 増刊号 樹状突起の形態形成: ドーパミンD1受容体 および Rho ファミリー GTPase による制御
- 2014年11月/12月号 GTPase 活性化アッセイ: アイソフォームの検出
- 2014年10月号 アルギニンの正電荷を消失させるシトルリン化
- 2014年9月号 キネシンサブドメインの探索
- 2014年9月号 増刊号 アクチン結合タンパク質コフィリンの S-ニトロシル化: 細胞移動に対する影響
- 2014年8月号 増刊号 原発性硬化性胆管炎における N-Ras 発現および活性
- 2014年8月号 SUMO化: 細胞骨格タンパク質を標的とした翻訳後修飾
- 2014年7月号 Sos/K-Ras 結合を介して Ras シグナル伝達を制御する新しい低分子阻害剤
- 2014年6月号 増刊号 頭頸部扁平上皮癌における microRNA-138 による RhoC のダウンレギュレーション
- 2014年6月号 Rho GTPase と活性酸素種: クロストークとフィードバック
- 2014年5月号 ミオシンのアセチル化はサルコメアの構造と機能を調節する
- 2014年4月号 リジンのアセチル化 - 多様な細胞プロセスの制御因子
- 2014年3月号 インテグリンを介したβ-アクチンの酸化還元制御: PDIの出現
- 2014年1/2月号 ダイニン: 一つのモーターが関わる複数の神経変性疾患
2013年
- 2013年11/12月号 ダイニン:チームとして強力に作用するモータータンパク質
- 2013年10月号 神経変性:Rhes、SUMO化、ハンチントン病
- 2013年9月号 モノユビキチン化:タンパク質調節のダイナミックなタグ
- 2013年8月号 Ras及びRhoのプレニル化による翻訳後修飾:癌創薬における役割
- 2013年7月号 アクチンが引き起こす膜突起による浸潤:コルタクチン
- 2013年6月号 アクチン修飾と細胞骨格
- 2013年5月号 微小管内部の実体
- 2013年4月号 神経変性におけるTauの多面性
- 2013年3月号 蛍光フィブロネクチンタンパク質を用いた特発性肺線維症の創薬
- 2013年1/2月号 樹状突起棘:発生におけるArf6の役割
2012年
- 2012年11/12月号 ミオシンの小分子モジュレーター
- 2012年10月号 Rhoファミリーパスウェイのユビキチン化と制御
- 2012年9月号 神経変性におけるRac1 GTPaseの機能
- 2012年8月号 上皮間葉転換(EMT)とRhoファミリー低分子量G-タンパク質の関与
- 2012年7月号 チューブリンの多重修飾:グルタミル化とグリシル化
- 2012年6月号 細胞接着のフィブロネクチン制御と原線維形成
- 2012年5月号 アクチン酸化サイクルの機能
- 2012年4月号 トラフィッキング:ArfとCdc42/Racの結合
- 2012年3月号 G-LISAを用いた心臓研究: 糖尿病性心筋症におけるRho経路に関する研究
- 2012年1月/2月号 FtsZ: 新たな抗生剤の標的となるチュ−ブリンホモログ
商品は「研究用試薬」です。人や動物の医療用・臨床診断用・食品用としては使用しないように、十分ご注意ください。
※ 表示価格について























 このページを印刷する
このページを印刷する













